
Fyysisen maailman tapahtumat liittyvät erottamattomasti toisiinsalämpötilan muutokset. Jokainen tuntee hänet varhaislapsuudessa, kun hän tajuaa, että jää on kylmä ja kiehuva vesi palaa. Samalla syntyy ymmärrys siitä, että lämpötilan muutosprosesseja ei tapahdu välittömästi. Myöhemmin koulussa opiskelija oppii, mikä liittyy lämmön liikkumiseen. Ja lämpötilaan liittyvät prosessit, varataan koko fysiikan osa.

Tämä tieteellinen käsite otettiin käyttöön tavallisenehdoin. Kuuma, kylmä tai lämmin sanat näkyvät jatkuvasti jokapäiväisessä elämässä. He kaikki puhuvat kehon lämpöä. Näin se määritellään fysiikassa, vain sillä lisämäärällä, että se on skalaarinen määrä. Lämpötilalla ei kuitenkaan ole mitään suuntaa, vaan vain numeerinen arvo.
Kansainvälisessä yksiköiden (SI) lämpötilan järjestelmässämitataan Celsius-asteina (ºС). Monissa lämpöilmiöitä kuvaavissa kaavoissa on kuitenkin käännettävä se Kelviniksi (K). Tähän on yksinkertainen kaava: T = t + 273. Siinä T on Kelvinin lämpötila ja t on Celsius. Absoluuttisen nollan lämpötilan käsite liittyy Kelvin-asteikkoon.
Lämpötilaa on useita.Esimerkiksi Euroopassa ja Amerikassa Fahrenheitin (F) aikana. Siksi niiden on pystyttävä tallentamaan celsiusasteina. Tätä varten on tarpeen vähentää 32 todistuksesta F: ssä ja jakaa se sitten 1,8: lla.

Selityksessään vaaditaan tuntemaan sellaiset käsitteet kuin lämpötila, lämpöliike. Ja kokemus on helppo saavuttaa.
Hänelle sinun on otettava kolme astiaa.Niiden tulisi olla riittävän suuret, jotta ne sopivat kätesi helposti. Täytä ne eri lämpötilojen vedellä. Ensimmäisessä sen pitäisi olla hyvin kylmä. Toisessa - lämmitetty. Kaada kuumaa vettä kolmanteen, jossa on mahdollista pitää kättä.
Nyt itse kokemus. Kasta vasen kätesi kylmään vesisäiliöön ja oikea kätesi kuumimpaan. Odota muutama minuutti. Ota ne pois ja upota ne välittömästi lämpimään veteen.
Tulos on odottamaton.Vasen käsi tuntee veden olevan lämmin, oikea tuntee kylmän veden tunteen. Tämä johtuu siitä, että terminen tasapaino syntyy aluksi niiden nesteiden kanssa, joihin kädet alun perin upotetaan. Ja sitten tämä tasapaino häiriintyy rajusti.
Se kuvaa kaikkia lämpöilmiöitä. Ja nämä lausunnot ovat melko yksinkertaisia. Siksi nämä ehdot on tunnettava lämpöliikkeestä käytävässä keskustelussa.
Ensimmäinen:aineita muodostavat pienimmät hiukkaset, jotka sijaitsevat tietyllä etäisyydellä toisistaan. Lisäksi nämä hiukkaset voivat olla sekä molekyylejä että atomeja. Ja niiden välinen etäisyys on monta kertaa suurempi kuin hiukkaskoko.
Toiseksi: kaikissa aineissa on molekyylien lämpöliike, joka ei koskaan pysähdy. Tässä tapauksessa hiukkaset liikkuvat satunnaisesti (kaoottisesti).
Kolmas: hiukkaset ovat vuorovaikutuksessa toistensa kanssa. Tämä toiminta johtuu vetovoimasta ja karkottamisesta. Niiden arvo riippuu hiukkasten välisestä etäisyydestä.
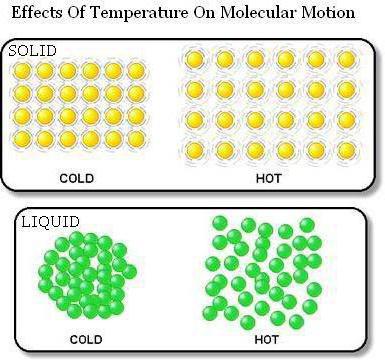
Todiste siitä, että kappaleet on valmistettu hiukkasista,joiden välissä on aukkoja, palvelee niiden lämpölaajeneminen. Joten kun keho lämmitetään, sen koko kasvaa. Tämä johtuu hiukkasten poistumisesta toisistaan.
Toinen vahvistus yllä olevasta ondiffuusio. Toisin sanoen yhden aineen molekyylien tunkeutuminen toisen hiukkasten väliin. Lisäksi tämä liike osoittautuu molemminpuoliseksi. Diffuusio tapahtuu sitä nopeammin, mitä kauempana molekyylit ovat toisistaan. Siksi kaasuissa keskinäinen tunkeutuminen tapahtuu paljon nopeammin kuin nesteissä. Ja kiintoaineissa diffuusio kestää vuosia.
Muuten jälkimmäinen prosessi selittää myös lämpöliikkeen. Loppujen lopuksi aineiden keskinäinen tunkeutuminen toisiinsa tapahtuu ilman ulkopuolista häiriötä. Mutta sitä voidaan kiihdyttää kuumentamalla kehoa.
Selkeä todiste siitälämpöliike on hiukkasten Brownin liike. Sitä pidetään suspendoituneiden hiukkasten eli niiden osalta, jotka ovat merkittävästi suurempia kuin aineen molekyylit. Nämä hiukkaset voivat olla hiukkasia pölystä tai jyvistä. Ja niiden on tarkoitus sijoittaa veteen tai kaasuun.
Painotetun liikkeen häiriötön syyhiukkasia siinä, että molekyylit vaikuttavat siihen kaikilta puolilta. Heidän toimintansa on arvaamatonta. Vaikutusten suuruus kullakin ajanhetkellä on erilainen. Siksi tuloksena oleva voima on suunnattu tavalla tai toisella.
Jos puhumme molekyylien lämpöliikkeen nopeudesta, sille on erityinen nimi - neliöjuuri. Se voidaan laskea kaavalla:
v = √ [(3kT) / m0u.
Siinä T on lämpötila Kelvineinä, m0 Onko yhden molekyylin massa, k on Boltzmannin vakio (k = 1,38 * 10-23 J / K).

Hiukkaset houkuttelevat ja karkottavat. Selitettäessä monia lämpöliikkeeseen liittyviä prosesseja tämä tieto osoittautuu tärkeäksi.
Loppujen lopuksi vuorovaikutusvoimat riippuvat aggregaatistaaineen tila. Joten kaasuilla ei käytännössä ole niitä, koska hiukkaset poistuvat niin paljon, että niiden vaikutus ei ilmene. Nesteissä ja kiinteissä aineissa ne ovat havaittavissa ja varmistavat aineen tilavuuden säilymisen. Jälkimmäisessä ne takaavat myös muodon säilymisen.
Todiste vetovoimien olemassaolosta jahylkääminen on elastisten voimien esiintyminen kappaleiden muodonmuutoksen aikana. Joten venymällä molekyylien väliset vetovoimat kasvavat, ja puristamalla, hylkivät. Mutta molemmissa tapauksissa ne palauttavat ruumiin alkuperäiseen muotoonsa.

Se voidaan kirjoittaa MKT: n perusyhtälöstä:
(pV) / N = (2E) / 3.
Tässä kaavassa p on paine, V on tilavuus, N on molekyylien lukumäärä ja E on keskimääräinen kineettinen energia.
Toisaalta tämä yhtälö voidaan kirjoittaa seuraavasti:
(pV) / N = kT.
Jos yhdistät ne, saat seuraavan tasa-arvon:
(2E) / 3 = kT.
Siitä seuraa seuraava kaava molekyylien keskimääräiselle kineettiselle energialle:
E = (3 kt) / 2.
Tästä voidaan nähdä, että energia on verrannollinenaineen lämpötila. Toisin sanoen kun jälkimmäinen nousee, hiukkaset liikkuvat nopeammin. Tämä on lämpöliikkeen ydin, joka on olemassa niin kauan kuin on jokin muu lämpötila kuin absoluuttinen nolla.


























