
Liuokset ovat kahden tai useamman aineen tai seoksen homogeeninen massa tai seos, jossa yksi aine toimii liuottimena ja toinen liukoisena hiukkasena.
Alkuperän tulkinnasta on olemassa kaksi teoriaaratkaisut: kemialliset, joiden perustaja on D. I. Mendeleev, ja fysikaaliset, saksalaisten ja sveitsiläisten fyysikkojen Ostwaldin ja Arrheniuksen ehdottamat. Mendelejevin tulkinnan mukaan liuottimen ja liuenneen aineosan komponenteista tulee kemiallisessa reaktiossa, kun muodostuu epästabiileja yhdisteitä näistä samoista komponenteista tai hiukkasista.
Fysikaalinen teoria kieltää kemiallisenliuottimen ja liuenneen aineen molekyylien välinen vuorovaikutus, joka selittää liuosten muodostumisprosessin liuottimen hiukkasten (molekyylien, ionien) tasaisena jakautumisena liuenneen aineen hiukkasten välillä fysikaalisen ilmiön, jota kutsutaan diffuusiona, välille.
Nykyään ei ole olemassa yhtenäistä ratkaisujen luokittelujärjestelmää, mutta ehdollisesti ratkaisutyypit voidaan ryhmitellä tärkeimpien kriteerien perusteella, toisin sanoen:
I) Yhdistelmätilan mukaan päästöt: kiinteät, kaasumaiset ja nestemäiset liuokset.
II) Liuenneen aineen partikkelikoko: kolloidinen ja tosi.
III) Liuoksessa olevan liuenneen aineen hiukkasten pitoisuusasteen mukaan: tyydyttyneet, tyydyttymättömät, konsentroidut, laimennetut.
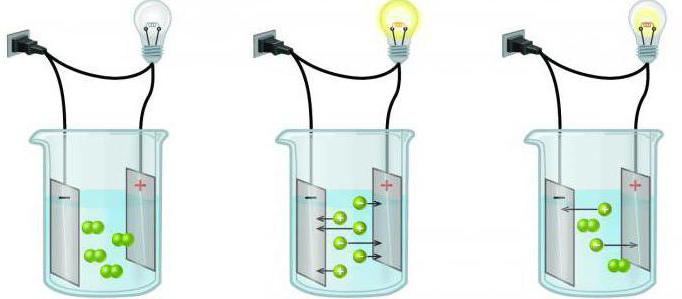
IV) kyky johtaa sähkövirtaa: elektrolyytit ja ei-elektrolyytit.
V) Tarkoituksen ja laajuuden mukaan: kemialliset, lääketieteelliset, rakennus-, erikoisratkaisut jne.
Ratkaisujen luokittelu aggregaatiotilan mukaanliuotin on annettu termin laajassa merkityksessä. Nestemäisiä aineita on tapana pitää liuoksina (lisäksi sekä nestemäiset että kiinteät elementit voivat toimia liukoisina aineina), mutta ottaen huomioon tosiasian, että liuos on kahden tai useamman aineen homogeeninen järjestelmä, on myös loogista tunnistaa myös kiinteät liuokset, ja kaasumaista. Kiinteitä liuoksia pidetään esimerkiksi useiden metallien seoksina, tunnetaan yleisemmin seoksina. Kaasumaiset ratkaisut ovat useiden kaasujen seoksia, esimerkki on ympäröivä ilma, joka esitetään hapen, typen ja hiilidioksidin yhdistelmänä.

Tyypit liuenneita liuenneiden hiukkasten koon mukaansisältävät tosi (tavalliset) ratkaisut ja kolloidiset järjestelmät. Oikeissa liuoksissa liukoinen aine hajoaa pieniksi molekyyleiksi tai atomeiksi, kooltaan samanlaisia kuin liuottimen molekyylit. Tässä tapauksessa tosi tyyppiset liuokset säilyttävät liuottimen alkuperäiset ominaisuudet muuttaen sitä vain hiukan siihen lisätyn alkuaineen fysikaalis-kemiallisten ominaisuuksien vaikutuksesta. Esimerkiksi: Kun liuotetaan ruokasuolaa tai sokeria veteen, vesi pysyy samassa aggregaatiotilassa ja saman konsistenssin, melkein saman värin kanssa, vain sen maku muuttuu.

Kolloidiliuokset eroavat tavallisista.että lisätty komponentti ei hajoa kokonaan, säilyttäen monimutkaiset molekyylit ja yhdisteet, joiden koot ovat huomattavasti suuremmat kuin liuotinpartikkelit, ylittäen yhden nanometrin arvon.
Samaan määrään liuotinta voidaan lisätä erilaisia määriä liuentavaa elementtiä; meillä on liuoksia, joilla on eri pitoisuudet ulostulossa. Luettelemme tärkeimmät:
Jotkut liuosten aineet hajoavationit, jotka kykenevät johtamaan sähkövirtaa. Sellaisia homogeenisia järjestelmiä kutsutaan elektrolyyteiksi. Tähän ryhmään kuuluvat hapot, useimmat suolat. Ja ratkaisuja, jotka eivät johda sähkövirtaa, kutsutaan yleensä ei-elektrolyyteiksi (melkein kaikki orgaaniset yhdisteet).
Ratkaisut ovat välttämättömiä kaikilla talouden aloilla, joiden spesifisyys on luonut erityyppisiä erityisratkaisuja kuten lääketieteen, rakennusalan, kemian ja muut.
Lääketieteelliset ratkaisut ovat yhdistelmävalmisteet voiteiden, suspensioiden, seosten, infuusio- ja injektioliuosten muodossa ja muut lääkemuodot, joita käytetään lääketieteellisiin tarkoituksiin erilaisten sairauksien hoitamiseksi ja ehkäisemiseksi.

Kemiallisiin liuoksiin sisältyyvaltava määrä homogeenisia yhdisteitä, joita käytetään kemiallisissa reaktioissa: hapot, suolat. Nämä liuokset voivat olla orgaanista tai epäorgaanista alkuperää, vesipitoisia (merivesi) tai vedettömiä (perustuen bentseeniin, asetoniin jne.), Nestemäisiä (vodkaa) tai kiinteitä (messinkiä). He löysivät sovelluksensa kansantalouden eri aloilla: kemian-, elintarvike- ja tekstiiliteollisuudessa.
Laastityypit eroavat viskoosista ja paksusta koostumuksesta, minkä vuoksi seoksen nimi sopii heille paremmin.



























