
De nos jours, la physique est devenue très courante.science. Littéralement, c'est partout. L'exemple le plus élémentaire: un pommier pousse dans votre cour et des fruits y mûrissent, le moment vient et les pommes commencent à tomber, mais dans quelle direction tombent-elles? Grâce à la loi de la gravitation universelle, notre fœtus tombe au sol, c'est-à-dire qu'il descend, mais pas vers le haut. Ce fut l'un des exemples les plus célèbres de la physique, mais prêtons attention à la thermodynamique, ou plutôt aux équilibres de phase, qui ne sont pas moins importants dans nos vies.

Pour commencer, regardons ce terme.Θερμοδυναμική- voici à quoi ressemble le mot en grec. La première partie Θερμо signifie "chaleur" et la seconde δυναμική - "force". La thermodynamique est une branche de la physique qui étudie les propriétés d'un système macroscopique, ainsi que diverses façons de convertir et de transférer de l'énergie. Dans cette section, divers états et processus sont spécialement étudiés afin que le concept de température puisse être introduit dans la description (il s'agit d'une grandeur physique qui caractérise un système thermodynamique et qui est mesurée à l'aide de certains instruments). Tous les processus dans les systèmes thermodynamiques ne sont décrits que par des valeurs microscopiques (pression et température, ainsi que la concentration des composants).
Chaque physicien connaît cette équation, mais disonsnous allons le démonter en plusieurs parties. Il se réfère aux processus d'équilibre de la transition d'une certaine matière d'une phase à l'autre. Cela se voit clairement dans de tels exemples: fusion, évaporation, sublimation (l'une des méthodes de conservation des produits, qui passe par l'élimination complète de l'humidité). La formule montre clairement les processus en cours:

L'équation de Clapeyron-Clausius estune excellente explication mathématique de la deuxième loi de la thermodynamique. Également appelé «inégalité Clausius». Naturellement, le théorème a été développé par le scientifique lui-même, qui voulait expliquer la relation entre le flux de chaleur dans le système et l'entropie, ainsi que son environnement. Clausius a développé cette équation dans ses tentatives d'expliquer l'entropie et de la déterminer en quantités. Au sens littéral, le théorème nous permet de déterminer si un processus cyclique est réversible ou irréversible. Cette inégalité nous offre une formule quantitative pour comprendre la deuxième loi.
Le scientifique a été l'un des premiers à travailler sur cette idée.entropie, et a même donné un nom à ce processus. Ce qui est maintenant connu comme le théorème de Clausius a été publié pour la première fois en 1862 dans le sixième ouvrage de Rudolph «Sur l'utilisation du théorème d'équivalence des transformations pour le travail à l'intérieur». Le scientifique a tenté de montrer une relation proportionnelle entre l'entropie et le flux d'énergie par chauffage (δ À) dans le système.Dans la construction, cette énergie thermique peut être convertie en travail, et elle peut être transformée en chaleur par un processus cyclique. Rudolph a prouvé que «la somme algébrique de toutes les transformations qui ont lieu dans un processus cyclique ne peut être inférieure à zéro ou, dans les cas extrêmes, égale à zéro».

Un système isolé est l'une des méthodes suivantes:
Malgré le fait que le sujet soit lié en interne à sa propre gravité, un système isolé est généralement pris en dehors des forces gravitationnelles externes et autres forces distantes.
Cela peut être mis en contraste avec le fait quela terminologie plus générale utilisée en thermodynamique) est appelée système fermé, couvert de parois sélectives à travers lesquelles l'énergie peut être transférée sous forme de chaleur ou de travail, mais pas de matière. Et avec un système ouvert dans lequel la matière et l'énergie entrent ou sortent, bien qu'elle puisse avoir divers murs impénétrables dans certaines parties de ses frontières.
Un système isolé est soumis à la loi de conservation. Le plus souvent en thermodynamique, la matière et l'énergie sont considérées comme des concepts distincts.
Pour comprendre les transitions de phase quantiques, il est utileles faire correspondre avec des transformations classiques (également appelées conversions thermiques). CPT décrit la pointe des propriétés thermodynamiques du système. Il signale une réorganisation des particules. Un exemple typique est la transition de congélation de l'eau, qui décrit la transition en douceur entre un liquide et un solide. Les excroissances de phases classiques sont dues à la compétition entre l'énergie du système et l'entropie de ses fluctuations thermiques.
Le système classique n'a pas d'entropie àune température nulle et, par conséquent, une transformation de phase ne peut pas se produire. Leur ordre est déterminé par la première dérivée discontinue du potentiel thermodynamique. Et, bien sûr, il a le premier ordre. Les transformations de phase d'un ferromagnet à un paramagnet sont continues et ont un second ordre. Ces changements constants de la phase ordonnée à la phase désordonnée sont décrits par le paramètre d'ordre, qui est égal à zéro. Pour la transformation ferromagnétique précitée, le paramètre d'ordre sera la magnétisation totale du système.
L'énergie libre de Gibbs est le maximum nombre d'emplois sans extension pouvantêtre retiré d'un système fermé thermodynamique (qui peut échanger de la chaleur et travailler avec l'environnement). Un tel résultat maximum ne peut être obtenu que dans un processus complètement réversible. Lorsqu'un système est transformé de manière opposée du premier état au second, la diminution de l'énergie libre de Gibbs est égale à celle effectuée par le système dans son environnement, moins le travail des forces de pression.

Équilibre thermodynamique et mécaniqueest un concept axiomatique de la thermodynamique. Il s'agit de l'état interne d'un ou de plusieurs systèmes reliés par des parois plus ou moins perméables ou imperméables. Dans cet état, il n'y a pas de flux macroscopiques purs provenant de la matière ou de l'énergie, que ce soit à l'intérieur d'un système ou entre des systèmes.
Dans sa propre conception de l'Étataucun changement macroscopique à l'équilibre interne ne se produit. Les systèmes sont simultanément en équilibre thermique, mécanique, chimique (constantes) et de rayonnement. Ils peuvent être sous une seule forme. Dans ce processus, toutes les espèces sont sauvées immédiatement et un temps infini jusqu'à ce que le fonctionnement physique soit perturbé. En équilibre macroscopique, des échanges équilibrés parfaitement précis se produisent. Les preuves ci-dessus sont une explication physique de ce concept.
Chaque loi, théorème, formule a ses propres fondements. Analysons les 3 bases de la loi de l'équilibre des phases.

Gibbs Factory Rule a été proposé par JosiahWillard Gibbs dans son célèbre article intitulé «The Equilibrium of Heterogeneous Substances», publié de 1875 à 1878. Elle est appliquée à des systèmes hétérogènes multicomposants non réactifs en équilibre thermodynamique et est une égalité donnée:
Le nombre de degrés de liberté est le nombre de personnes inoccupéesvariables intensives. Le plus grand nombre de paramètres thermodynamiques, tels que la température ou la pression, qui peuvent varier simultanément et arbitrairement sans s'influencer les uns les autres. Un exemple de système à un composant est celui avec un seul produit chimique pur, tandis que les systèmes à deux composants, tels que des mélanges d'eau et d'éthanol, ont deux composants indépendants. Les transitions de phase typiques (équilibre de phase) sont les solides, les liquides, les gaz.

Pour les applications en science des matériaux,concernant les changements de phase entre différentes structures solides, une pression constante survient souvent (par exemple, dans la même atmosphère) et est ignorée en tant que degré de liberté, de sorte que la règle devient: F = Avec - P + 1.
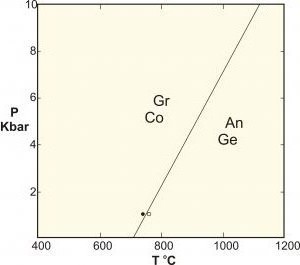
Parfois, cette formule est introduite sous le nom de "règleavec une phase condensée », mais, on le sait, elle n'est pas applicable à ces systèmes, qui sont soumis à des pressions élevées (par exemple, en géologie), car les conséquences de ces pressions peuvent entraîner des conséquences catastrophiques.
Il peut sembler que l'équilibre de phase est justeun son vide, et dans quelques processus physiques ce moment est impliqué, mais, comme nous l'avons vu, sans lui, de nombreuses lois que nous savons ne fonctionnent pas, vous devez donc vous familiariser un peu avec ces règles uniques, colorées, quoique un peu ennuyeuses . Cette connaissance a aidé de nombreuses personnes. Ils ont appris à les appliquer à eux-mêmes, par exemple, les électriciens, connaissant les règles de travail avec les phases, peuvent se protéger d'un danger inutile.


























