
Estudo dos processos que ocorrem na estatísticasistemas, complicados pelo tamanho mínimo das partículas e seu grande número. É praticamente impossível considerar cada partícula separadamente, por isso são introduzidas quantidades estatísticas: a velocidade média das partículas, sua concentração, a massa da partícula. A fórmula que caracteriza o estado do sistema levando em consideração parâmetros microscópicos é chamada de equação básica da teoria cinética molecular dos gases (MKT).
A determinação da velocidade do movimento das partículas foi primeirorealizado experimentalmente. O experimento conhecido no currículo escolar, realizado por Otto Stern, possibilitou criar uma ideia das velocidades das partículas. No decorrer do experimento, o movimento dos átomos de prata em cilindros giratórios foi investigado: primeiro no estado estacionário da instalação, depois quando girava com uma determinada velocidade angular.
Como resultado, verificou-se que a velocidade das moléculasa prata excede a velocidade do som e é de 500 m / s. O fato é bastante interessante, pois é difícil para uma pessoa sentir tamanha velocidade de movimento das partículas nas substâncias.
Parece possível continuar a pesquisaapenas em um sistema cujos parâmetros podem ser determinados por medições diretas usando instrumentos físicos. A velocidade é medida com um velocímetro, mas a ideia de anexar um velocímetro a uma única partícula é absurda. Apenas um parâmetro macroscópico associado ao movimento das partículas pode ser medido diretamente.
Qualquer sistema de corpos interagindocaracterizado por energia potencial e energia cinética de movimento. O gás real é um sistema complexo. A variabilidade da energia potencial não se presta à sistematização. O problema pode ser resolvido com a introdução de um modelo que carregue as propriedades características do gás, varrendo de lado a complexidade da interação.
Um gás ideal é um estado da matéria em quea interação das partículas é desprezível, a energia potencial de interação tende a zero. Apenas a energia do movimento, que depende da velocidade das partículas, pode ser considerada significativa.

Revelar a relação entre a pressão do gás e a velocidadeo movimento de suas partículas permite a equação básica do MKT de um gás ideal. Uma partícula que se move em um navio, ao colidir com a parede, transfere para ela um impulso, cujo valor pode ser determinado com base na lei II de Newton:
Uma mudança no momento de uma partícula durante um impacto elástico está associada a uma mudança no componente horizontal de sua velocidade. F é a força agindo da partícula na parede por um curto período de tempo t; m0 - massa da partícula.
Todas as partículas de gás, movendo-se na direção da superfície com uma velocidade vcom e localizado em um cilindro de volume SυcomΔt. A uma concentração de partículas n, exatamente metade das moléculas se movem em direção à parede, a outra metade - na direção oposta.
Tendo considerado a colisão de todas as partículas, podemos escrever a lei de Newton para a força que atua no local:
Uma vez que a pressão do gás é definida como a razão entre a força atuando perpendicularmente à superfície e a área desta última, podemos escrever:
A relação resultante como a equação básica do MKT não pode descrever todo o sistema, uma vez que apenas o movimento em uma direção é considerado.
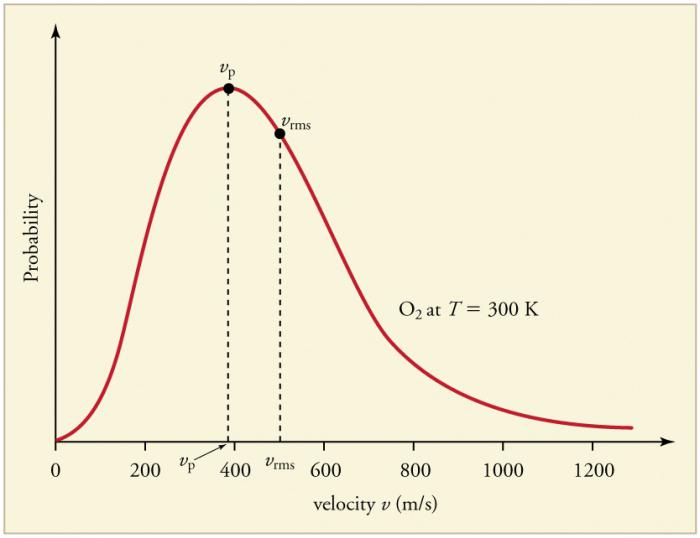
Colisões frequentes e contínuas de partículas de gás comparedes e entre si levam ao estabelecimento de uma certa distribuição estatística de partículas sobre velocidades (energias). As direções de todos os vetores de velocidade são igualmente prováveis. Essa distribuição é chamada de distribuição Maxwell. Em 1860, esse padrão foi deduzido por J. Maxwell com base no MKT. Os principais parâmetros da lei de distribuição são chamados de velocidades: o provável, correspondendo ao valor máximo da curva, e a raiz quadrada média v.sq. = √ ‹v2›- quadrado médio da velocidade da partícula.
Um aumento na temperatura do gás corresponde a um aumento no valor da velocidade.
Com base no fato de que todas as velocidades são iguais e seus módulos têm o mesmo valor, podemos considerar:
A equação básica do MKT, levando em consideração o valor médio da pressão do gás, tem a forma:
Essa proporção é única, pois determina a relação entre os parâmetros microscópicos: velocidade, massa da partícula, concentração da partícula e pressão do gás em geral.
Usando o conceito de energia cinética das partículas, a equação básica do MKT pode ser reescrita de forma diferente:
A pressão do gás é proporcional à energia cinética média de suas partículas.
É interessante que para uma quantidade constante de gás emum vaso fechado, você pode relacionar a pressão do gás e o valor médio da energia do movimento das partículas. Neste caso, a medição da pressão pode ser realizada medindo a energia das partículas.
Como proceder? Que quantidade pode ser comparada com a energia cinética? Esse valor acaba sendo a temperatura.


Mais interessante em termos de independência deas propriedades do fluido de trabalho podem ser consideradas termômetros de gás. Sua escala é independente do tipo de gás usado. Em tal dispositivo, pode-se hipoteticamente selecionar a temperatura na qual a pressão do gás tende a zero. Os cálculos mostram que este valor corresponde a -273,15 oDE. A escala de temperatura (escala de temperatura absoluta ou escala Kelvin) foi introduzida em 1848. A possível temperatura de pressão zero do gás foi tomada como o ponto principal desta escala. O segmento da unidade da escala é igual ao valor da unidade da escala Celsius. É mais conveniente escrever a equação básica do MKT usando a temperatura ao estudar processos de gás.
Empiricamente, você pode ter certeza de que a pressão do gás é proporcional à sua temperatura. Ao mesmo tempo, verificou-se que a pressão é diretamente proporcional à concentração de partículas:
onde Т é a temperatura absoluta, k é um valor constante igual a 1,38 • 10-23J / K.
A quantidade fundamental que tem um valor constante para todos os gases é chamada de constante de Boltzmann.
Comparando a dependência da pressão com a temperatura e a equação básica dos gases MKT, você pode escrever:
O valor médio da energia cinética de movimento das moléculas de gás é proporcional à sua temperatura. Ou seja, a temperatura pode servir como uma medida da energia cinética do movimento das partículas.


























