Elektrodipotentiaali on erosähköstaattiset potentiaalit elektrolyytin ja elektrodin välillä. Tällaisen potentiaalin esiintyminen johtuu varausten spatiaalisesta erottelusta, joilla on vastakkaiset merkit vaiheenerotusrajassa muodostettaessa sähköinen kaksikerros.

Latausten tilaerotus rajallametallielektrodin ja elektrolyyttiliuoksen välillä liittyy sellaisiin ilmiöihin kuin ionien siirtyminen metallista liuokseen sähkökemiallisen tasapainon muodostumisen aikana, samoin kuin ionien adsorptio elektrolyytistä elektrodin pintaan; kaasun siirtyminen ionisesti positiivisesti varautuneen kidehilan ulkopuolella; Ionien tai nestemäisten molekyylien adsorptio ei-coulomb-elektrodilla. Kahdesta jälkimmäisestä ilmiöstä johtuen elektrodipotentiaali ei ole koskaan nolla, vaikka varaus metallipinnalla olisi nolla. Yksittäisen elektrodin potentiaalin absoluuttista arvoa ei määritetä, tähän käytetään vertailu- ja tutkittujen elektrodien vertailumenetelmää. Elektrodipotentiaali on yhtä suuri kuin sähkökemiallisessa piirissä saadun sähkömoottorivoiman (EMF) arvo.
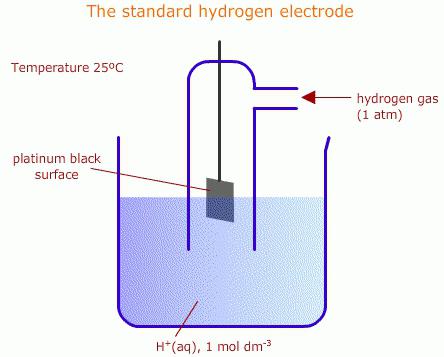
Vesipohjaisiin ratkaisuihin se hyväksytäänkäytä vetyelektroodeja. Tämän tyyppisiä vakiokennoja käytetään normeina erilaisissa sähkökemiallisissa mittauksissa, samoin kuin galvaanisissa laitteissa. Vetyelektrodi on lanka- tai metallilevy, joka imee vetykaasun hyvin (palladiumia tai platinaa käytetään usein). Tällainen levylanka tyydytetään vedyllä ilmakehän paineessa ja upotetaan sitten vesipitoiseen liuokseen, jossa on runsaasti vetyioneja. Tällaisen levyn potentiaali on verrannollinen ionien pitoisuuteen liuoksessa. Elementti on standardi, kemiallisen reaktion elektrodipotentiaali mitataan suhteessa siihen.
Kun galvaanisia kennoja kootaan,vety ja määritetyt laitteet platinaryhmän metallin pinnalla, tapahtuu reaktio (palautuva), mikä tarkoittaa joko pelkistys- tai hapetusprosessia. Prosessityyppi riippuu määritetyn elementin käynnissä olevan reaktion potentiaalista. Vetyelektrodin potentiaalin oletetaan olevan nolla, kun vedyn paine on yksi ilmakehä, liuosprotoonien konsentraatio on yksi mooli litrassa ja lämpötila on 298 K. Jos tutkittava elementti on vertailuolosuhteissa, ts. Kun potentiaaliin vaikuttavien ionien aktiivisuus on yhtenäinen, ja kaasun paine - 0,011 MPa, tämän potentiaalin arvoa kutsutaan vakiona.

Galvaanisen elektrodin EMF: n mittausstandardiolosuhteet, laske kemiallisen reaktion vakioelektrodipotentiaali. Yleensä tämä arvo mitataan olosuhteissa, joissa kaikki potentiaalia määrittävän reaktion termodynaamiset aktiivisuudet ovat yhtä suuria ja kaasun paine on 0,01 * 105 Pa. Testattavan elementin potentiaalia pidetään positiivisena, jos "virtalähteen" moodissa elektronit liikkuvat ulkoisesta piiristä vasemmalta oikealle ja positiivisesti varautuneet hiukkaset liikkuvat elektrolyytissä.






























