
L'article ci-dessous parle de l'atomeet sa structure: comment elle a été découverte, comment la théorie a été développée dans leur esprit et au cours des expériences, des penseurs et des scientifiques. Le modèle quantique-mécanique de l'atome, le plus moderne aujourd'hui, décrit le mieux son comportement et les particules qui composent la composition. Lisez à propos d'elle et de ses fonctionnalités ci-dessous.

Pièce minimale chimiquement indivisibleUn élément chimique avec un ensemble de propriétés caractéristiques est un atome. Il comprend des électrons et un noyau qui, à son tour, contient des protons chargés positivement et des neutrons non chargés. S'il contient le même nombre de protons et d'électrons, alors l'atome lui-même sera électriquement neutre. Sinon, il a une charge: positive ou négative. Ensuite, l'atome est appelé un ion. Ainsi, leur classification est effectuée: un élément chimique est déterminé par le nombre de protons, et son isotope par les neutrons. Se liant les uns aux autres sur la base de liaisons interatomiques, les atomes forment des molécules.
Pour la première fois, les anciens Indiens etphilosophes de la Grèce antique. Et dans la période des XVIIe et XVIIIe siècles, les chimistes ont confirmé l'idée, prouvant expérimentalement que certaines substances ne peuvent pas être divisées en leurs éléments constitutifs par des expériences chimiques. Cependant, de la fin du XIXe au début du XXe siècle, les physiciens ont découvert des particules subatomiques, montrant clairement que l'atome n'est pas indivisible. En 1860, les chimistes ont formulé les concepts d'atome et de molécule, où l'atome est devenu la plus petite particule de l'élément, qui faisait partie à la fois de substances simples et complexes.

Ce modèle est un développement du précédent.Le modèle de mécanique quantique d'un atome suggère qu'il n'y a pas de neutrons de charge et de protons chargés positivement dans le noyau d'un atome. Autour d'elle se trouvent des électrons chargés négativement. Mais en mécanique quantique, les électrons ne se déplacent pas le long de trajectoires définies prédéterminées. Ainsi, en 1927, W. Heisenberg a exprimé le principe d'incertitude, qui rend impossible de déterminer avec précision la coordonnée d'une particule et sa vitesse ou son élan.
Les propriétés chimiques des électrons sont déterminées par leurcoquille. Dans le tableau périodique, les atomes sont disposés en fonction des charges électriques des noyaux (nous parlons du nombre de protons), tandis que les neutrons n'affectent pas les propriétés chimiques. Le modèle quantique-mécanique de l'atome a prouvé que sa masse se trouve dans le noyau, tandis que la fraction d'électrons reste insignifiante. Il est mesuré en unités atomiques de masse, ce qui équivaut à 1/12 de la masse de l'atome d'isotope de carbone de C12.

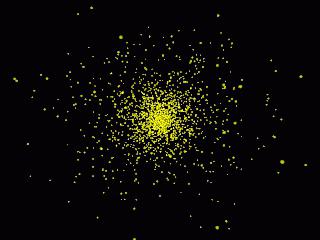
Selon le principe B.Heisentberg, on ne peut pas dire avec une certitude absolue qu'un électron qui a une certaine vitesse se trouve à un point particulier de l'espace. Afin de décrire les propriétés des électrons, utilisez la fonction d'onde psi.
La probabilité de détecter une particule dans un particulierle temps est directement proportionnel au carré de son module, qui est calculé pour un temps spécifique. Le psi au carré est appelé densité de probabilité, qui caractérise les électrons autour du noyau sous la forme d'un nuage d'électrons. Plus il est grand, plus il est probable que l'électron dans un certain espace de l'atome soit plus élevé.
Pour une meilleure compréhension, vous pouvez imaginerphotos superposées les unes sur les autres, où la position de l'électron est fixée à différents moments. À l'endroit où il y aura plus de points et le nuage deviendra le plus dense et la plus forte probabilité de trouver un électron.
Il est calculé, par exemple, que le modèle de mécanique quantique de l'atome d'hydrogène inclut la densité la plus élevée d'un nuage d'électrons situé à une distance de 0,053 nanomètres du noyau.
L'orbite de la mécanique classique remplacéenuage d'électrons quantiques. La fonction d'onde de l'électron psi est appelée orbitale, qui est caractérisée par la forme et l'énergie du nuage d'électrons dans l'espace. Appliqué à un atome, nous entendons l'espace autour du noyau dans lequel la présence d'un électron est la plus probable.

Comme toute la théorie, le modèle mécanique quantiquela structure atomique a véritablement révolutionné le monde scientifique et parmi les habitants. En effet, à ce jour, il est difficile d'imaginer qu'une même particule à un seul et même moment puisse être simultanément non pas en un, mais en des endroits différents! Pour protéger les structures établies, il est dit que des événements se produisent dans le micromonde qui sont impensables et ne le sont pas dans le macrocosme. Mais est-ce vraiment le cas? Ou les gens ont-ils simplement peur d'admettre même la possibilité qu '«une goutte est comme un océan et un océan est une goutte»?


























