
Une liaison chimique est la liaison entre deux ou plusieurs atomes (molécules) dans un composé organique ou inorganique. Il se forme lorsque l'énergie totale du système diminue.
Tous les éléments du tableau périodique ont descapacité à former une communication. Les plus stables et, par conséquent, chimiquement inactifs sont les atomes de gaz nobles (inertes), car ils contiennent deux ou huit électrons sur la couche externe des électrons. Ils forment un petit nombre de liens. Par exemple, le néon, l'hélium et l'argon ne forment de liaisons chimiques avec aucun élément, tandis que le xénon, le krypton et le radon peuvent réagir avec les molécules de fluor et d'eau.
Pour les atomes d'autres éléments, les niveaux externes ne sont pas terminés et ont de un à sept électrons, par conséquent, pour augmenter la stabilité des coquilles, ils forment des liaisons chimiques.
Il existe plusieurs types de communication:
Ce type de liaison est formé entre les atomes dansmolécule résultant de la socialisation ou du chevauchement d'une paire d'électrons de valence. En conséquence, il existe des mécanismes d'échange (a) et de donneur-accepteur (b) pour la formation d'une liaison covalente. Un cas distinct est le lien datif, qui sera discuté ci-dessous.

Les atomes du niveau externe ne sont pas appariésélectrons. Lors de l'interaction, les coques extérieures se chevauchent. Les spins antiparallèles des électrons uniques contenus dans les niveaux externes se couplent pour former une paire d'électrons commune aux deux atomes. Cette paire d'électrons est en fait une liaison covalente, qui est formée par un mécanisme d'échange, par exemple dans une molécule d'hydrogène.
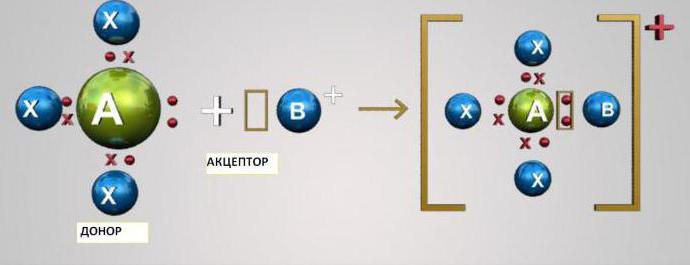
Ce mécanisme consiste à socialiserdeux atomes de deux électrons au niveau extérieur. Dans ce cas, l'un des atomes agit comme un donneur (fournit deux électrons) et l'autre - un accepteur (a une orbitale vide pour les électrons). Les atomes des éléments s et p peuvent être soit des accepteurs, soit des donneurs d'électrons. Les atomes d'élément D sont capables d'être à la fois donneurs et accepteurs.
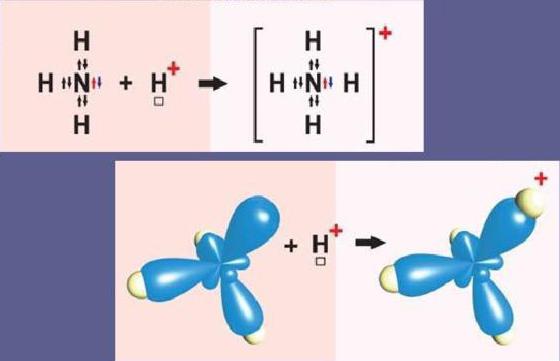
Pour comprendre ce qu'est le mécanisme donneur-accepteur, considérons deux exemples les plus simples - la formation de cations hydronium H3Oh+ et NH d'ammonium4+.
Schématiquement, la réaction de formation d'une particule d'ammonium est la suivante:
NN3+ H+= NH4+
Les électrons de l'atome N sont répartis dans l'ordre suivant: 1s2 2 s2 2p3.
Structure électronique du cation H: 1s0.
L'atome d'azote au niveau extérieur contient deux s- ettrois p-électrons. Trois p-électrons participent à la formation de trois liaisons de type échange covalentes azote-hydrogène N-H. Cela se traduit par la formation d'une molécule d'ammoniac NH3 avec une liaison covalente. Puisque l'atome d'azote N au niveau extérieur a une paire d'électrons s, le NH3 peut également ajouter un cation hydrogène. La molécule d'ammoniac est un donneur et le cation hydrogène H+ - un accepteur qui accepte les électrons donneurs de l'azote vers sa propre orbitale s libre.
Les électrons de l'atome d'oxygène sont répartis dans l'ordre suivant: 1s2 2 s2 2p4.
L'atome d'oxygène au niveau extérieur a deux s etquatre p-électrons. Sur cette base, deux électrons p libres et deux électrons s de deux atomes H participent à la formation de liaisons H-O. Autrement dit, 2 liaisons existantes dans la molécule H2O - covalent, formé par le mécanisme d'échange.
Structure électronique du cation hydrogène: 1s0.
Depuis l'atome d'oxygène au niveau extérieuril reste encore deux électrons (de type s), il peut former une troisième liaison de type covalent par le mécanisme donneur-accepteur. Un accepteur peut être un atome avec une orbitale libre, dans cet exemple c'est une particule H+... L'orbitale s libre du H+ occupent deux électron(s) de l'atome d'oxygène.

Mécanisme donneur-accepteur de la liaison covalenteest possible non seulement dans les interactions de type « atome-atome » ou « molécule-atome », mais aussi dans les réactions se produisant entre molécules. La seule condition pour l'interaction donneur-accepteur de molécules cinétiquement indépendantes est une diminution de l'entropie, en d'autres termes, une augmentation de l'ordre de la structure chimique.
Considérons le premier exemple - la formation d'acide aprotique (acide de Lewis) NH3petit ami3... Ce complexe inorganique se forme lors de la réaction d'addition d'une molécule d'ammoniac et de fluorure de bore.
NN3+ BF3= NH3petit ami3
Les électrons de l'atome de bore sont répartis dans l'ordre suivant : 1s2 2 s2 2p1.
Lors de l'excitation de l'atome B, un électron de type s passe au sous-niveau p (1s2 2 s1 2p2). Ainsi, il y a deux électrons s et deux p au niveau externe d'un atome de bore excité.
Dans la molécule BF3 trois liaisons covalentes bore-fluor B-F sont forméestype d'échange (les atomes de bore et de fluor fournissent chacun un électron). Après la formation de trois liaisons covalentes dans l'atome de bore, un sous-niveau p libre reste sur la couche externe d'électrons, grâce à quoi la molécule de fluorure de bore peut agir comme un accepteur d'électrons.
Les électrons de l'atome d'azote sont répartis dans l'ordre suivant : 1s2 2 s2 2p3.
Trois électrons chacun des atomes N et H participent àla formation d'une liaison azote-hydrogène. Après cela, l'azote a encore deux électrons de type s, qu'il peut fournir pour la formation d'une liaison par le mécanisme donneur-accepteur.
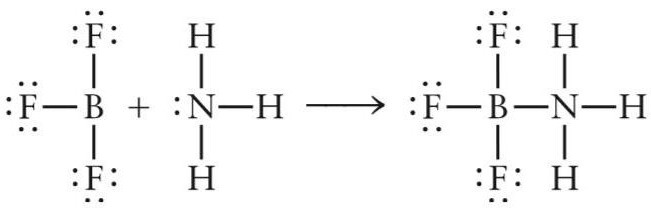
Dans la réaction d'interaction du trifluorure de bore et de l'ammoniac, la molécule NH3 joue le rôle d'un donneur d'électrons, et le BF3 - un accepteur. Une paire d'électrons d'azote occupe l'orbitale libre du fluorure de bore et un composé chimique NH se forme3petit ami3.
Un autre exemple de mécanisme de formation d'une liaison donneur-accepteur est la production d'un polymère de fluorure de béryllium.
La réaction est schématiquement la suivante :
BeF2+ BeF2+… + BeF2-> (BeF2)M.
Les électrons de l'atome Be sont disposés comme suit - 1s2 2 s2, et dans l'atome F - 1s2 2 s2 2p5.
Deux liaisons béryllium-fluor dans la molécule de fluorure de béryllium sont de type échange covalent (deux électrons p de deux atomes de fluor et deux électrons du sous-niveau s de l'atome de béryllium sont impliqués).
Entre une paire d'atomes de béryllium (Be) et de fluor (F)deux autres liaisons covalentes sont formées par le mécanisme donneur-accepteur. Dans le polymère du fluorure de béryllium, l'atome de fluor est le donneur d'électrons, l'atome de béryllium est leur accepteur, qui a une orbitale vacante.
Lorsque la connexion est formée parau mécanisme considéré entre les molécules de nature organique, des composés plus complexes se forment - des complexes. Tout composé organique avec une liaison covalente contient à la fois des orbitales occupées (non liantes et liantes) et vides (desserrées et non liantes). La possibilité de formation de complexes donneur-accepteur est déterminée par le degré de stabilité du complexe, qui dépend de la force de liaison.
Prenons un exemple : réaction d'interactionmolécules de méthylamine avec de l'acide chlorhydrique pour former du chlorure de méthylammonium. Dans la molécule de méthylamine, toutes les liaisons sont covalentes, formées par le mécanisme d'échange - deux liaisons H-N et une liaison N-CH3... Après combinaison avec de l'hydrogène et du méthylegroupe, l'atome d'azote a une paire d'électrons de type s. En tant que donneur, il fournit cette paire d'électrons à l'atome d'hydrogène (accepteur), qui possède une orbitale libre.

Pas dans tous les cas de donneur-accepteurl'interaction est la socialisation de la paire d'électrons et la formation d'une liaison. Certains composés organiques peuvent se combiner en raison du chevauchement de l'orbitale donneuse remplie avec l'orbitale acceptrice vide. Un transfert de charge se produit - les électrons sont délocalisés entre l'accepteur et le donneur, qui sont très proches l'un de l'autre. Des complexes de transfert de charge (CTC) se forment.
Cette interaction est typique des systèmes pi,dont les orbitales se chevauchent facilement, et les électrons sont facilement polarisés. Les métallocènes, les composés aminés insaturés, le TDAE (tétrakis (diméthylamino) éthylène) peuvent agir comme donneurs. Les fullerènes et les quinodiméthanes avec des substituants accepteurs sont souvent des accepteurs.
Le transfert de charge peut être partiel ou complet. Le transfert de charge complet se produit lors de la photoexcitation de la molécule. Cela forme un complexe qui peut être observé spectralement.
Indépendamment de l'intégralité du transfert de charge, de telsles complexes sont instables. Pour augmenter la résistance et la durée de vie d'un tel état, un groupe pont est en outre introduit. En conséquence, les systèmes donneurs-accepteurs sont utilisés avec succès dans les dispositifs de conversion d'énergie solaire.
Dans certaines molécules organiques, la liaisonle mécanisme donneur-accepteur se forme à l'intérieur de la molécule entre les groupes donneur et accepteur. Ce type d'interaction est appelé effet transannulaire, caractéristique par exemple des atranes (composés organo-élémentaires à liaisons N->B, N->Si).
En plus de l'échange et du donneur-accepteur, il y ale troisième mécanisme est datif (les autres noms sont semi-polaire, semi-polaire ou communication de coordination). L'atome donneur donne une paire d'électrons à l'orbitale vacante de l'atome neutre, qui a besoin de deux électrons pour compléter le niveau externe. Il y a une sorte de transition de la densité électronique de l'accepteur au donneur. Dans ce cas, le donneur se charge positivement (cation) et l'accepteur se charge négativement (anion).
La liaison chimique réelle est formée en raison decouche de liaison (chevauchement de deux électrons appariés de l'un des atomes de l'orbitale libre externe de l'autre) et attraction électrostatique se produisant entre le cation et l'anion. Ainsi, les types covalent et ionique sont combinés dans la liaison semi-polaire. Une liaison semi-polaire est caractéristique des éléments d qui, dans différents composés, peuvent jouer à la fois le rôle d'accepteur et de donneur. Dans la plupart des cas, il se trouve dans des substances complexes et organiques.
L'exemple le plus simple est une molécule de chlore.Un atome de Cl donne une paire d'électrons à un autre atome de chlore, qui a une orbitale d libre. Dans ce cas, un atome de Cl est chargé positivement, l'autre négativement, et une attraction électrostatique se produit entre eux. En raison de sa grande longueur, la liaison dative a une force inférieure par rapport à l'échange covalent et au type donneur-accepteur, mais sa présence augmente la force de la molécule de chlore. C'est pourquoi la Cl2 plus fort que F2 (l'atome de fluor n'a pas d'orbitales d, la liaison fluor-fluor n'est qu'un échange covalent).
Molécule de monoxyde de carbone CO (monoxyde de carbone)formé de trois liaisons C-O. Étant donné que les atomes d'oxygène et de carbone ont deux électrons uniques au niveau externe, deux liaisons d'échange covalentes se forment entre eux. Après cela, l'atome de carbone a une orbitale vacante et l'atome O a deux paires d'électrons au niveau externe. Par conséquent, dans la molécule de monoxyde de carbone (II), il existe une troisième liaison - une liaison semi-polaire, formée en raison de deux électrons d'oxygène appariés à valence et d'une orbitale libre de carbone.
Considérons un exemple plus complexe - la formation de ce type de liaison par l'exemple de l'interaction de l'éther diméthylique (Н3С-О-СН3) avec du chlorure d'aluminium AlCl3... L'atome d'oxygène dans l'éther diméthylique est lié par deuxliaisons covalentes avec des groupes méthyle. Après cela, il a encore deux autres électrons sur le sous-niveau p, qu'il donne à l'atome accepteur (aluminium) et devient un cation positif. Dans ce cas, l'atome accepteur acquiert une charge négative (se transforme en anion). Le cation et l'anion interagissent électrostatiquement l'un avec l'autre.
Le mécanisme de formation du lien donneur-accepteurest important dans la vie humaine et est répandu dans les composés chimiques de nature organique et inorganique, ce qui est confirmé par les exemples discutés ci-dessus. L'alcool d'ammonium, qui contient un cation ammonium, est utilisé avec succès dans la vie quotidienne, la médecine et la production industrielle d'engrais. L'ion hydronium joue un rôle majeur dans la dissolution des acides dans l'eau. Le monoxyde de carbone est utilisé dans l'industrie (par exemple, dans la production d'engrais, de systèmes laser) et revêt une grande importance dans les systèmes physiologiques du corps humain.


























