
Nel nostro tempo, la fisica è diventata molto comune.scienza. Letteralmente, è presente ovunque. L'esempio più elementare: un melo cresce nel tuo giardino e su di esso stanno maturando i frutti, arriva il momento e le mele iniziano a cadere, ma in che direzione cadono? Grazie alla legge di gravitazione universale, il nostro frutto cade a terra, cioè scende, ma non su. Questo è stato uno degli esempi più famosi di fisica, ma rivolgiamo la nostra attenzione alla termodinamica, o più precisamente, agli equilibri di fase, che non sono meno importanti nella nostra vita.

Per prima cosa, diamo un'occhiata a questo termine.Θερμοδυναμική- ecco come appare una parola in greco. La prima parte Θερμо significa "calore" e la seconda δυναμική - "forza". La termodinamica è una branca della fisica che studia le proprietà di un sistema macroscopico, nonché vari modi di convertire e trasferire energia. In questa sezione, vari stati e processi vengono studiati in modo specifico in modo che il concetto di temperatura possa essere introdotto nella descrizione (questa è una grandezza fisica che caratterizza un sistema termodinamico e viene misurata utilizzando determinati strumenti). Tutti i processi che si verificano nei sistemi termodinamici sono descritti solo da quantità microscopiche (pressione e temperatura, nonché la concentrazione dei componenti).
Ogni fisico conosce questa equazione, ma faccelo sapereAnalizziamolo in parti. Si riferisce ai processi di equilibrio della transizione di una certa materia da una fase all'altra. Questo si vede chiaramente in questi esempi: fusione, evaporazione, sublimazione (uno dei metodi di conservazione dei prodotti, che avviene rimuovendo completamente l'umidità). La formula mostra chiaramente i processi in corso:

L'equazione di Clapeyron-Clausius èun'ottima spiegazione matematica della seconda legge della termodinamica. Chiamato anche "disuguaglianza di Clausius". Naturalmente, il teorema è stato sviluppato dallo scienziato stesso, che ha voluto spiegare la relazione tra il flusso di calore nel sistema e l'entropia, nonché il suo ambiente. Clausius ha sviluppato questa equazione nei suoi tentativi di spiegare l'entropia e quantificarla. In senso letterale, il teorema ci consente di determinare se un processo ciclico è reversibile o irreversibile. Questa disuguaglianza ci offre una formula quantitativa per comprendere la seconda legge.
Lo scienziato è stato uno dei primi a lavorare sull'ideaentropia, e ha persino dato un nome a questo processo. Quello che oggi è conosciuto come il teorema di Clausius fu pubblicato per la prima volta nel 1862 nel sesto lavoro di Rodolfo "Sull'uso del teorema di equivalenza della trasformazione per il lavoro interiore". Lo scienziato ha cercato di mostrare una relazione proporzionale tra entropia e flusso di energia riscaldando (δ Q) nel sistema.Nella costruzione, questa energia termica può essere convertita in lavoro e può essere convertita in calore attraverso un processo ciclico. Rudolph ha dimostrato che "la somma algebrica di tutte le trasformazioni che avvengono in un processo ciclico può essere solo minore di zero o, in casi estremi, uguale a zero".

Un sistema isolato è uno dei seguenti:
Nonostante il fatto che il soggetto si riferisca internamente alla propria gravità, un sistema isolato viene solitamente portato oltre i limiti delle forze gravitazionali esterne e di altre forze distanti.
Ciò può essere contrastato dal fatto che (interminologia più generale utilizzata in termodinamica) è chiamato sistema chiuso, circondato da pareti selettive attraverso le quali l'energia può essere trasferita sotto forma di calore o lavoro, ma non materia. E con un sistema aperto in cui entrano o escono materia ed energia, sebbene possa avere varie pareti impenetrabili in alcune parti dei suoi confini.
Un sistema isolato obbedisce alla legge di conservazione. Molto spesso, in termodinamica, materia ed energia sono considerati concetti separati.
Per comprendere le transizioni di fase quantistiche, è utileconfrontali con le trasformazioni classiche (chiamate anche inversioni termiche). CPT descrive il punto di cuspide nelle proprietà termodinamiche di un sistema. Segnala la riorganizzazione delle particelle. Un tipico esempio è la transizione gelida dell'acqua, che descrive una transizione graduale tra un liquido e un solido. Le escrescenze della fase classica sono dovute alla competizione tra l'energia del sistema e l'entropia delle sue fluttuazioni termiche.
Il sistema classico non ha entropia atemperatura zero e, quindi, la trasformazione di fase non può avvenire. Il loro ordine è determinato dalla prima derivata discontinua del potenziale termodinamico. E, naturalmente, è di prim'ordine. Le trasformazioni di fase da ferromagnete a paramagnete sono continue e hanno il secondo ordine. Questi cambiamenti costanti dalla fase ordinata a quella disordinata sono descritti dal parametro order, che è uguale a zero. Per la suddetta trasformazione ferromagnetica, il parametro di ordine rappresenterà la magnetizzazione totale del sistema.
L'energia libera di Gibbs è la massima numero di opere senza estensione che puòessere rimosso da un sistema chiuso termodinamico (che può scambiare calore e lavorare con l'ambiente). Questo massimo risultato può essere ottenuto solo in un processo completamente reversibile. Quando il sistema si trasforma in modo opposto dal primo stato al secondo, la diminuzione dell'energia libera di Gibbs è uguale a quella eseguita dal sistema nel suo ambiente, meno il lavoro delle forze di pressione.

Equilibrio termodinamico e meccanicoè un concetto assiomatico della termodinamica. Questo è lo stato interno di uno o più sistemi collegati da pareti più o meno permeabili o impermeabili. In questo stato, non ci sono flussi macroscopici puri dalla materia o dall'energia, né all'interno di un sistema né tra i sistemi.
Nel suo concetto di statonon vi è alcun cambiamento macroscopico negli equilibri interni. I sistemi sono simultaneamente in reciproci equilibri termici, meccanici, chimici (costanti) e di radiazione. Possono essere nella stessa forma. In questo processo, tutte le specie vengono preservate contemporaneamente e per un periodo di tempo infinito finché l'operazione fisica non viene interrotta. Nell'equilibrio macroscopico avvengono scambi bilanciati perfettamente accurati. La prova di cui sopra è la spiegazione fisica di questo concetto.
Ogni legge, teorema, formula ha i propri fondamenti. Diamo uno sguardo alle 3 basi della legge dell'equilibrio di fase.

La Gibbs Factory Rule è stata proposta da JosiahDi Willard Gibbs nel suo famoso articolo intitolato Equilibrium of Heterogeneous Substances, pubblicato dal 1875 al 1878. Si applica a sistemi eterogenei multicomponenti non reattivi in equilibrio termodinamico ed è una data uguaglianza:
Il numero di gradi di libertà è il numero di non occupativariabili intensive. Il maggior numero di parametri termodinamici, come la temperatura o la pressione, che possono variare simultaneamente e arbitrariamente senza influenzarsi a vicenda. Un esempio di un sistema monocomponente è quello con una sostanza chimica pura, mentre i sistemi bicomponenti, come le miscele di acqua ed etanolo, hanno due componenti indipendenti. Le transizioni di fase tipiche (equilibrio di fase) sono solidi, liquidi, gas.

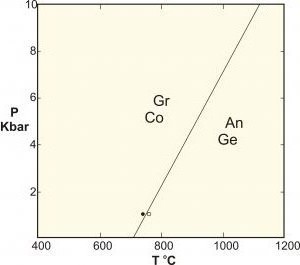
Per applicazioni nella scienza dei materiali,per quanto riguarda i cambiamenti di fase tra diverse strutture solide, spesso si verifica una pressione costante (ad esempio, nella stessa atmosfera) e viene ignorata come grado di libertà, quindi la regola diventa: F = C - P + 1.
A volte questa formula viene introdotta con il nome "regolacon una fase condensata ”, ma, come sappiamo, non è applicabile a questi sistemi, che sono soggetti ad alte pressioni (ad esempio, in geologia), poiché le conseguenze di queste pressioni possono causare conseguenze catastrofiche.
Può sembrare che l'equilibrio di fase sia giustouna frase vuota, e in pochi processi fisici questo momento è coinvolto, ma, come abbiamo visto, molte leggi che conosciamo non funzionano senza di essa, quindi è necessario acquisire un po 'di familiarità con queste regole uniche, colorate, anche se un po' noiose. Questa conoscenza ha aiutato molte persone. Hanno imparato ad applicarli a se stessi, ad esempio gli elettricisti, conoscendo le regole per lavorare con le fasi, possono proteggersi da pericoli inutili.


























