
Ammoniaca - idrogeno nitruro - uno dei più importanti composti di azoto e idrogeno. È un gas senza colore, ma con un odore pungente. La composizione chimica riflette la formula dell'ammoniaca - NH3. Aumentare la pressione o abbassare la temperaturala sostanza porta alla sua trasformazione in un liquido incolore. L'ammoniaca gassosa e le sue soluzioni sono ampiamente utilizzate nell'industria e nell'agricoltura. In medicina si usa il 10% di idrossido di ammonio - ammoniaca.
La molecola di idrogeno nitruro ha la forma diuna piramide, alla base della quale è legato l'azoto a tre atomi di idrogeno. I legami N-H sono fortemente polarizzati. L'azoto attrae fortemente la coppia di elettroni di legame. Pertanto, una carica negativa si accumula su N atomi, uno positivo si concentra sull'idrogeno. Un'idea di questo processo è data dal modello della molecola, la formula elettronica e strutturale dell'ammoniaca.

Il nitruro di idrogeno è molto solubile in acqua.(700: 1 a 20 ° C). La presenza di protoni praticamente liberi porta alla formazione di numerosi "ponti" di idrogeno che collegano le molecole l'una all'altra. Le caratteristiche della struttura e il legame chimico portano anche al fatto che l'ammoniaca è facilmente liquefatta con l'aumentare della pressione o la diminuzione della temperatura (-33 ° C).

Il termine "ammoniaca" è stato introdotto nell'uso scientifico in1801 su suggerimento del chimico russo J. Zakharov, ma la sostanza dell'umanità è familiare alla profonda antichità. Durante la decomposizione dei sali di ammonio, durante la decomposizione dei sali di ammonio, viene rilasciato un gas con un odore pungente quando vengono prodotti prodotti di scarto, molti composti organici, come le proteine e l'urea. Gli storici della chimica credono che la sostanza sia stata chiamata in onore dell'antico dio egiziano Amon. Nel Nord Africa c'è un'oasi di Siwa (Ammon). Circondato dal deserto libico, vi sono rovine di un'antica città e un tempio, accanto ai quali si trovano depositi di cloruro di ammonio. Questa sostanza in Europa era chiamata "sale di Amon". C'è una leggenda che gli abitanti dell'oasi di Siwa hanno annusato il sale nel tempio.
Fisico e chimico inglese R.Negli esperimenti, Boyle ha bruciato letame e ha osservato la formazione di fumo bianco su un bastone immerso in acido cloridrico e introdotto nel flusso del gas risultante. Nel 1774, un altro chimico britannico, D. Priestley, riscaldò il cloruro di ammonio con calce spenta e liberò una sostanza gassosa. Priestley chiamava il composto "aria alcalina", perché la sua soluzione mostrava le proprietà di una base debole. È stata spiegata l'esperienza di Boyle, in cui l'ammoniaca ha reagito con l'acido cloridrico. Il cloruro di ammonio solido bianco si verifica quando le molecole dei reagenti entrano in contatto direttamente nell'aria.

La formula chimica dell'ammoniaca fu stabilita nel1875 dal francese K. Berthollet, che condusse un esperimento sulla decomposizione di una sostanza nelle sue componenti costitutive sotto l'azione di una scarica elettrica. Fino ad ora, gli esperimenti di Priestley, Boyle e Berthollet sono stati riprodotti in laboratori per la produzione di nitruro di idrogeno e cloruro di ammonio. Un metodo industriale fu sviluppato nel 1901 da A. Le Chatelier, che ricevette un brevetto per un metodo per sintetizzare una sostanza da azoto e idrogeno.

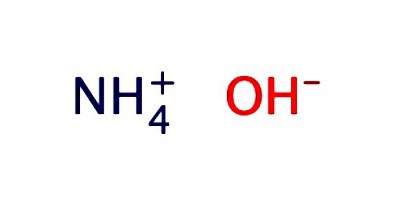
Una soluzione acquosa di ammoniaca viene solitamente registrata sotto forma di idrossido - NH4OH. Esibisce le proprietà degli alcali deboli:
Equilibrio nella reazione dell'interazione dell'ammoniaca conl'acqua si sposta verso le sostanze originali. Il nitruro di idrogeno preriscaldato brucia bene con l'ossigeno. L'azoto viene ossidato in molecole biatomiche della semplice sostanza N2. L'ammoniaca mostra anche proprietà riducenti in reazione con l'ossido di rame (II).

L'idrogeno nitruro è usato nella produzione di sale.ammonio e acido nitrico - uno dei prodotti più importanti dell'industria chimica. L'ammoniaca è usata come materia prima per la produzione di soda (con il metodo del nitrato). Il contenuto di idrogeno nitruro in una soluzione concentrata industriale raggiunge il 25%. In agricoltura viene utilizzata una soluzione acquosa di ammoniaca. Formula del fertilizzante liquido - NH4OH.La sostanza viene direttamente utilizzata sotto forma di top dressing. Altri modi per arricchire il suolo con l'azoto sono l'uso di sali di ammonio: nitrati, cloruri, fosfati. In condizioni industriali e in locali agricoli non è consigliabile conservare insieme concimi minerali contenenti sali di ammonio con alcali. Quando l'integrità dell'imballaggio viene compromessa, le sostanze possono reagire l'una con l'altra per formare ammoniaca e rilasciarla nell'aria interna. Il composto tossico influisce negativamente sul sistema respiratorio, il sistema nervoso centrale dell'uomo. Una miscela di ammoniaca e aria è esplosiva.


























