
Amonjaks - ūdeņradis nitrīds - viens no svarīgākajiem slāpekļa un ūdeņraža savienojumiem. Tas ir gāze bez krāsas, bet ar asu smaku. Ķīmiskais sastāvs atspoguļo amonjaka - NH formulu3. Увеличение давления или понижение температуры viela pārvēršas par bezkrāsainu šķidrumu. Gāzveida amonjaks un tā šķīdumi tiek plaši izmantoti rūpniecībā un lauksaimniecībā. Medicīnā lieto 10% amonija hidroksīdu - amonjaku.
Ūdens nitrīda molekula formas forma ir līdzīgapiramīdas, kuras pamatnē ir slāpeklis, savienots ar trim ūdeņraža atomiem. N-H saiti ir stipri polarizēti. Slāpeklis piesaista saistošo elektronu pāri vairāk. Tāpēc negatīvā uzlāde uzkrājas uz N atomiem, pozitīvs lādiņš koncentrējas uz ūdeņradi. Molekulas modelis, elektroniskais un strukturālais amonjaka formula, dod priekšstatu par šo procesu.

Ūdeņraža nitrīds ļoti labi izšķīst ūdenī(700: 1 20 ° C temperatūrā). Praktiski brīvo protonu klātbūtne noved pie daudzu ūdeņraža "tiltu" veidošanās, kas savieno molekulas kopā. Struktūras īpatnības un ķīmiskās saites rada arī to, ka amonjaks tiek viegli sašķidrināts palielinot spiedienu vai pazeminot temperatūru (-33 ° C).

Termins "amonjaks" tika ieviests zinātniskajā izmantošanā 2008. Gadā1801 pēc krievu ķīmiķa J. Zaharova ierosinājuma, bet cilvēces būtība ir pazīstama no dziļas senatnes. Gāzei ar asu smaku atbrīvojas, pūšot atkritumus, daudzus organiskos savienojumus, piemēram, olbaltumvielas un urīnvielu, amonija sāļu sadalīšanās laikā. Ķīmijas vēsturnieki uzskata, ka viela tika nosaukta par godu senajam Ēģiptes dievam Amonam. Ziemeļāfrikā ir Siwas (Ammona) oāze. Lībijas tuksnesī ieskauj ir senās pilsētas drupas un templis, pie kura atrodas amonija hlorīda nogulsnes. Šo vielu Eiropā sauca par "Amun sāli". Pastāv leģenda, ka Siwas ozonas iedzīvotāji šņēmis sāli.
Angļu fiziķis un ķīmiķis R.Eksperimentos Boyle sadedzināja kūtsmēslus un novēroja balto dūmu veidošanos virs sprauga, kas iemērc sālsskābē, un ievada iegūtās gāzes plūsmā. 1774. gadā kāds cits britu ķīmiķis D. Priestley sildīja amonija hlorīdu ar slīpētu kaļķi un izlaida gāzveida vielu. Priestley sauc par savienojumu "sārmains gaiss", jo tā risinājums parādīja vājās bāzes īpašības. Izskaidrota Boyle pieredze, kurā amonjaks reaģēja ar sālsskābi. Balts cietais amonija hlorīds rodas, ja reaģentu molekulas saskaras tieši ar gaisu.

Химическая формула аммиака была установлена в 1875. g. Franči K. Berthollets, kurš veica eksperimentu par vielas sadalīšanu tās sastāvdaļās elektriskās strāvas iedarbības rezultātā. Līdz šim laboratorijās tika reproducēti Priestley, Boyle un Berthollet eksperimenti ūdeņraža nitrīda un amonija hlorīda ražošanai. 1901. gadā A. Le Chatelier izstrādāja rūpniecisko metodi, kas saņēma patentu par metodi vielas sintezēšanai no slāpekļa un ūdeņraža.

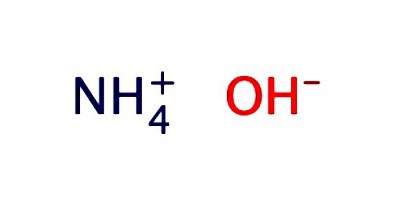
Amonjaka ūdens šķīdumu parasti reģistrē kā hidroksīdu - NH4OH Tai piemīt vāju sārmu īpašības:
Равновесие в реакции взаимодействия аммиака с ūdens virzās uz sākotnējām vielām. Iepriekš sasildīts ūdeņradis nitrīds labi sadedzina skābekli. Slāpeklis tiek oksidēts līdz vienkārtas vielas N2 divatomu molekulām. Reizēm ar vara (II) oksīdu arī amonjakam piemīt samazinātas īpašības.

Sāls ražošanā izmanto ūdeņraža nitrīdu.amonija un slāpekļskābes - viens no svarīgākajiem ķīmiskās rūpniecības produktiem. Amonjaks tiek izmantots kā izejmateriāls sodas ražošanai (ar nitrātu metodi). Ūdeņraža nitrīda saturs rūpnieciskā koncentrētā šķīdumā sasniedz 25%. Lauksaimniecībā izmanto amonjaka ūdens šķīdumu. Šķidro Fertilizer Formula - NH4OHVielu tieši izmanto augšējā mērcē. Citi veidi, kā bagātināt augsni ar slāpekli - amonija sāļu izmantošana: nitrāti, hlorīdi, fosfāti. Rūpnieciskajos apstākļos un lauksaimniecības telpās nav ieteicams kopā ar sārmiem uzglabāt minerālmēslus, kuros ir amonija sāļi. Ja tiek pārkāpta iepakojuma integritāte, vielas var savstarpēji reaģēt, veidojot amonjaku un atbrīvojot to iekštelpu gaisā. Toksisks savienojums nelabvēlīgi ietekmē elpošanas sistēmu, cilvēka centrālo nervu sistēmu. Amonjaka un gaisa maisījums ir sprādzienbīstams.


























