
De uitdrukking "ozonlaag", die in de jaren 70 beroemd werdjaar vorige eeuw, is al lang pijnlijk. Maar weinig mensen begrijpen echt wat dit concept betekent en wat het gevaar is van de vernietiging van de ozonlaag. Een nog groter mysterie voor velen is de structuur van het ozonmolecuul, maar het houdt rechtstreeks verband met de problemen van de ozonlaag. Laten we meer leren over ozon, de structuur en het gebruik ervan in de industrie.
Ozon, of, zoals het ook wel actieve zuurstof wordt genoemd, is een gas van azuurblauwe kleur met een scherpe metaalgeur.

Deze stof kan in alle drie aggregatietoestanden voorkomen: gasvormig, vast en vloeibaar.
Bovendien komt ozon in de natuur alleen voor in de vorm van gas en vormt het de zogenaamde ozonlaag. Door de azuurblauwe kleur lijkt de lucht blauw.
Ozon kreeg de bijnaam "actieve zuurstof"vanwege de gelijkenis met zuurstof. Het belangrijkste actieve chemische element in deze stoffen is dus zuurstof (O). Als het zuurstofmolecuul echter 2 van zijn atomen bevat, dan is het ozonmolecuul (formule - O3) bestaat uit 3 atomen van dit element.
Door deze structuur lijken de eigenschappen van ozon op zuurstof, maar zijn ze meer uitgesproken. In het bijzonder zoals O2Over3 is het sterkste oxidatiemiddel.
Het belangrijkste verschil tussen deze "gerelateerde"stoffen die essentieel zijn voor iedereen om te onthouden, de volgende: u kunt geen ozon inademen, het is giftig en als het wordt ingeademd, kan het de longen beschadigen of zelfs een persoon doden. Bovendien, O3 perfect voor het reinigen van lucht van giftige onzuiverheden. Trouwens, juist daarom ademt het zo gemakkelijk na regen: ozon oxideert de schadelijke stoffen in de lucht en wordt gezuiverd.
Ozon molecuul model (bestaande uit 3 atomenzuurstof) lijkt een beetje op een afbeelding van een hoek en heeft een grootte van 117 °. Dit molecuul heeft geen ongepaarde elektronen en is daarom diamagnetisch. Bovendien heeft het een polariteit, hoewel het uit atomen van één element bestaat.
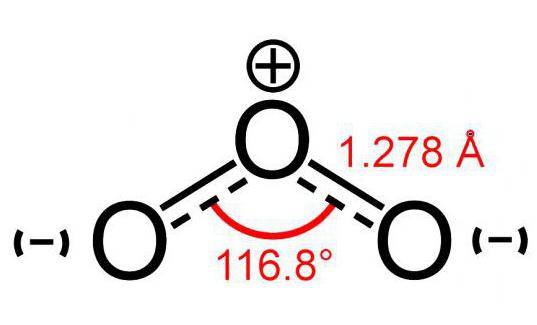
Twee atomen van dit molecuul zijn stevig met elkaar verbondenzelf. Maar de verbinding met de derde is minder betrouwbaar. Om deze reden is het ozonmolecuul (foto van het model hieronder te zien) erg kwetsbaar en valt het snel na vorming uiteen. In de regel bij elke vervalreactie O3 er komt zuurstof vrij.
Vanwege de instabiliteit van ozon kan het niet worden geoogst en opgeslagen, en ook niet worden vervoerd zoals andere stoffen. Om deze reden is de productie duurder dan andere stoffen.
Bovendien is de hoge activiteit van O-moleculen3 zorgt ervoor dat deze stof het sterkste oxidatiemiddel is, krachtiger dan zuurstof en veiliger dan chloor.
Als het ozonmolecuul wordt vernietigd en O vrijkomt2gaat deze reactie altijd gepaard met het vrijkomen van energie. Tegelijkertijd, om het omgekeerde proces te laten plaatsvinden (de vorming van O3 van Oh2), is het noodzakelijk om het niet minder uit te geven.
In gasvormige toestand het ozonmolecuulbreekt op bij een temperatuur van 70 ° C. Als het wordt verhoogd tot 100 graden of meer, zal de reactie aanzienlijk versnellen. De aanwezigheid van onzuiverheden versnelt ook de vervalperiode van ozonmoleculen.
In welke van de drie staten ozon zich ook bevindt, het blijft blauw. Hoe harder de stof, hoe rijker en donkerder deze tint.

Elk ozonmolecuul weegt 48 g / mol. Het is zwaarder dan lucht, wat helpt om deze stoffen onderling te scheiden.
oh3 kan bijna alle metalen en niet-metalen oxideren (behalve goud, iridium en platina).
Ook kan deze stof deelnemen aan de verbrandingsreactie, maar dit vereist een hogere temperatuur dan voor O2.
Ozon kan oplossen in N2Over en freons. In vloeibare toestand kan het worden gemengd met vloeibare zuurstof, stikstof, methaan, argon, tetrachloorkoolstof en kooldioxide.
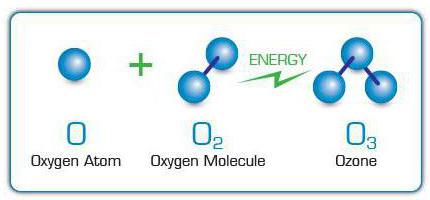
Moleculen over3 worden gevormd door vrije zuurstofatomen aan zuurstofmoleculen te hechten. Ze verschijnen op hun beurt door de splitsing van andere O-moleculen2 door blootstelling aan elektrische ontladingen,ultraviolette stralen, snelle elektronen en andere hoogenergetische deeltjes. Om deze reden kan de specifieke geur van ozon worden gevoeld in de buurt van sprankelende elektrische apparaten of lampen die ultraviolet licht uitstralen.

Industriële schaal O3 zenden uit met behulp van elektrische ozongeneratoren of ozonisatoren. Bij deze apparaten wordt een elektrische stroom met hoog voltage door de gasstroom geleid waarin O2waarvan de atomen dienen als het "bouwmateriaal" voor ozon.
Soms wordt zuivere zuurstof of gewone lucht in deze apparaten gelanceerd. De kwaliteit van het verkregen ozon hangt af van de zuiverheid van het uitgangsproduct. Dus medisch Oh3bedoeld voor de behandeling van wonden, alleen gewonnen uit chemisch zuivere O2.
Na te hebben begrepen hoe het ozonmolecuul eruitziet en hoe het wordt gevormd, is het de moeite waard om kennis te maken met de geschiedenis van deze stof.
Het is voor het eerst samengesteld door de Nederlandersonderzoeker Martin Van Marum in de tweede helft van de achttiende eeuw. De wetenschapper merkte op dat na het passeren van elektrische vonken door een container met lucht, het gas erin zijn eigenschappen veranderde. Tegelijkertijd begreep Van Marum niet dat hij moleculen van een nieuwe stof isoleerde.
Maar zijn Duitse collega, Scheinbein genaamd, probeert te ontbinden met behulp van elektriciteit2O tot H en O2, vestigde de aandacht op het vrijkomen van een nieuw gas met een penetrante geur. Na veel onderzoek te hebben gedaan, beschreef de wetenschapper de stof die hij ontdekte en gaf hem de naam "ozon" ter ere van het Griekse woord "geur".
Veel wetenschappers waren geïnteresseerd in het vermogen om schimmels en bacteriën te doden en de toxiciteit van schadelijke stoffen, die een open stof hadden, te verminderen. 17 jaar na de officiële opening van Oh3 Werner von Siemens ontwierp de eersteapparaat waarmee u ozon in elke hoeveelheid kunt synthetiseren. En na 39 jaar heeft de briljante Nikola Tesla 's werelds eerste ozongenerator uitgevonden en gepatenteerd.
Dit toestel was al 2 jaar later voor het eerstgebruikt in Frankrijk in afvalwaterzuiveringsinstallaties voor drinkwater. Met het begin van de twintigste eeuw. Europa begint voor de zuivering over te schakelen op de ozonisatie van drinkwater.
Het Russische rijk gebruikte deze techniek voor het eerst in 1911 en na 5 jaar waren er in het land bijna 4 dozijn installaties voor de zuivering van drinkwater met ozon uitgerust.
Tegenwoordig vervangt ozonisatie van water geleidelijk de chlorering. Dus 95% van al het drinkwater in Europa wordt behandeld met O3. Deze techniek is ook erg populair in de Verenigde Staten. In het GOS wordt het nog bestudeerd, want hoewel deze procedure veiliger en handiger is, is hij duurder dan chlorering.
Naast waterzuivering, Oh3 heeft een aantal andere toepassingen.
Op een afstand van 15-35 km boven het aardoppervlak bevindt zich de ozonlaag, of, zoals het ook wel wordt genoemd, de ozonosfeer. In deze plaats geconcentreerd Oh3 dient als een soort filter voor schadelijke zonnestraling.
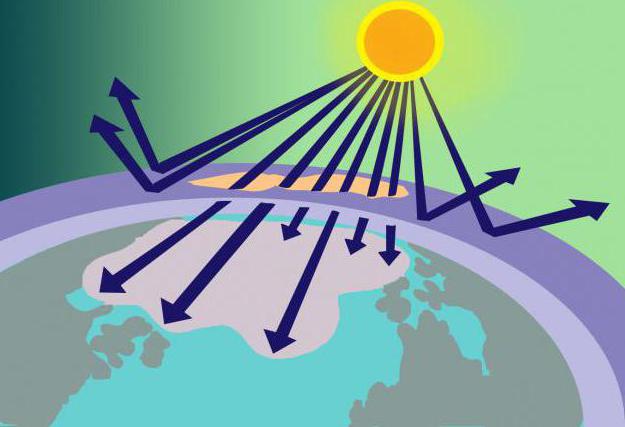
Waar komt deze hoeveelheid stof vandaan alszijn de moleculen instabiel? Het is niet moeilijk om deze vraag te beantwoorden als we ons het model van het ozonmolecuul herinneren en de methode voor de vorming ervan. Dus zuurstof, bestaande uit 2 zuurstofmoleculen, die de stratosfeer binnenkomen, wordt daar verwarmd door de zonnestralen. Deze energie is genoeg om O te splitsen2 aan de atomen waaruit O wordt gevormd3. Tegelijkertijd gebruikt de ozonlaag niet alleen een deel van de zonne-energie, maar filtert deze ook, absorbeert gevaarlijk ultraviolet.
Hierboven werd gezegd dat ozon wordt opgelost door freons.Deze gasvormige stoffen (gebruikt bij de vervaardiging van deodorants, brandblussers en koelkasten) tasten, eenmaal in de atmosfeer, ozon aan en dragen bij tot de afbraak ervan. Als gevolg hiervan ontstaan er gaten in de ozonosfeer waardoor ongefilterde zonnestralen op de planeet vallen, die levende organismen destructief beïnvloeden.
Gezien de kenmerken en structuur van ozonmoleculen, kunnen we concluderen dat deze stof, hoewel gevaarlijk, zeer nuttig is voor de mensheid, mits correct gebruikt.


























