
Grote rol voor normaal functionerenhet menselijk lichaam speelt een zuur-base-evenwicht. Het bloed dat in het lichaam circuleert, is een mengsel van levende cellen die worden aangetroffen in een vloeibare habitat. De eerste beveiligingsfunctie die de pH-waarde in het bloed regelt, is buffer systeem... Het is een fysiologisch mechanisme dat de parameters van het zuur-base-evenwicht in stand houdt en veranderingen in de pH voorkomt. We zullen hieronder zien wat het is en welke variëteiten het heeft.

Het buffersysteem is uniek mechanisme.Er zijn er verschillende in het menselijk lichaam en ze bestaan allemaal uit plasma en bloedcellen. Buffers zijn basen (eiwitten en anorganische verbindingen) die H + en OH- binden of afstaan, waardoor de pH-verschuiving binnen dertig seconden wordt opgeheven. Het vermogen van een buffer om een zuur-base-evenwicht te behouden, hangt af van het aantal elementen waaruit het is samengesteld.
Het bloed, dat constant in beweging is, zijn levende cellen die in een vloeibare omgeving bestaan. De pH is normaal 7,37-7,44. Bij een bepaalde buffer ontstaat een hoop ionen, classificatie van buffersystemen приведена ниже.Het zelf bestaat uit plasma- en bloedcellen en kan fosfaat, eiwit, bicarbonaat of hemoglobine zijn. Al deze systemen hebben een vrij eenvoudig werkingsmechanisme. Hun activiteit is gericht op het reguleren van het niveau van ionen in het bloed.
Het hemoglobinebuffersysteem is het meesthet krachtigste van allemaal, het is een alkali in de haarvaten van weefsels en een zuur in een inwendig orgaan zoals de longen. Het is goed voor ongeveer vijfenzeventig procent van de totale buffercapaciteit. Dit mechanisme is betrokken bij veel processen die plaatsvinden in menselijk bloed en bevat globine. Wanneer de hemoglobinebuffer overgaat in een andere vorm (oxyhemoglobine), wordt een verandering in deze vorm waargenomen en veranderen ook de zure eigenschappen van de werkzame stof.
De kwaliteit van het verminderde hemoglobine is lager,dan koolzuur, maar het wordt veel beter als het oxideert. Wanneer de pH zuur wordt, combineert hemoglobine waterstofionen, zodat deze al wordt verlaagd. Wanneer kooldioxide in de longen wordt gezuiverd, is de pH alkalisch. Op dit moment werkt het hemoglobine, dat is geoxideerd, als een protondonor, met behulp waarvan het zuur-base-evenwicht in evenwicht is. Dus de buffer, die bestaat uit oxyhemoglobine en zijn kaliumzout, bevordert de afgifte van kooldioxide uit het lichaam.
Dit buffersysteem speelt een belangrijke rolin het ademhalingsproces, omdat het een transportfunctie vervult voor het overbrengen van zuurstof naar weefsels en inwendige organen en het verwijderen van kooldioxide daaruit. Het zuur-base-evenwicht in de erytrocyten wordt op een constant niveau gehouden, dus ook in het bloed.
Dus als het bloed verzadigd is met zuurstof,hemoglobine verandert in een sterk zuur en als het zuurstof opgeeft, verandert het in een nogal zwak organisch zuur. De systemen van oxyhemoglobine en hemoglobine zijn onderling verwisselbaar, ze bestaan als één geheel.
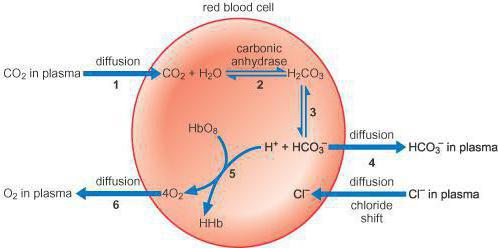
Bicarbonaatbuffersysteem werkt ook krachtig, maar ook het meest beheersbaar inorganisme. Het is goed voor ongeveer tien procent van de totale buffercapaciteit. Het heeft veelzijdige eigenschappen die het aan beide kanten effectief maken. Deze buffer bevat een geconjugeerd zuur-basenpaar, dat bestaat uit moleculen zoals koolzuur (protonenbron) en anionbicarbonaat (protonacceptor).
Zo draagt het bicarbonaatbuffersysteem bij aaneen systematisch proces waarbij krachtig zuur in de bloedbaan terechtkomt. Dit mechanisme bindt het zuur aan het bicarbonaat van anionen en vormt koolzuur en zijn zout. Wanneer alkali het bloed binnendringt, bindt de buffer zich aan koolzuur en vormt een bicarbonaatzout. Omdat er meer natriumbicarbonaat in menselijk bloed zit dan koolzuur, zal deze buffercapaciteit een hoge zuurgraad hebben. Met andere woorden, het bicarbonaatbuffersysteem (bicarbonaat) zeer goed in het compenseren van stoffen,die de zuurgraad van het bloed verhogen. Deze omvatten melkzuur, waarvan de concentratie toeneemt bij intensieve lichamelijke inspanning, en deze buffer reageert zeer snel op veranderingen in het zuur-base-evenwicht in het bloed.
Fosfaatbuffersysteem beslaat ongeveer twee procent van het totaalbuffercapaciteit, die wordt geassocieerd met het gehalte aan fosfaten in het bloed. Dit mechanisme houdt de pH in de urine en de vloeistof in de cellen in stand. De buffer bestaat uit anorganische fosfaten: monobasisch (werkt als een zuur) en dibasisch (werkt als een alkali). Bij een normale pH is de verhouding zuur tot base 1: 4. Met een toename van het aantal waterstofionen fosfaatbuffersysteem bindt zich aan hen om zuur te vormen. Dit mechanisme is zuurder dan alkalisch, dus het neutraliseert perfect zure metabolieten die het menselijk bloed binnendringen, bijvoorbeeld melkzuur.

Eiwitbuffer speelt een minder belangrijke rol instabilisatie van het zuur-base-evenwicht, in vergelijking met andere systemen. Het is goed voor ongeveer zeven procent van de totale buffercapaciteit. Eiwitten zijn opgebouwd uit moleculen die worden gecombineerd om zuur-base-verbindingen te vormen. In een zure omgeving werken ze als alkaliën die zuren binden; in een alkalische omgeving gebeurt alles andersom.
Dit leidt tot de formatie proteïne buffersysteemwat vrij effectief is bij pH-waardevan 7.2 tot 7.4. Een groot deel van de eiwitten zijn albumine en globulinen. Omdat de eiwitlading nul is, is deze bij normale pH in de vorm van alkali en zout. Deze buffercapaciteit is afhankelijk van de hoeveelheid eiwitten, hun structuur en vrije protonen. Deze buffer kan zowel zure als alkalische voedingsmiddelen neutraliseren. Maar het heeft een zuurrijker dan basisch vermogen.
Normaal gesproken hebben rode bloedcellen een constante pH- 7.25. Dit is waar bicarbonaat- en fosfaatbuffers werken. Maar ze verschillen in kracht van die in het bloed. In erytrocyten speelt de eiwitbuffer een speciale rol bij het voorzien van zuurstof in organen en weefsels, en bij het verwijderen van kooldioxide daaruit. Bovendien handhaaft het een constante pH-waarde in rode bloedcellen. De eiwitbuffer in erytrocyten is nauw verwant aan het bicarbonaatsysteem, aangezien de verhouding van zuur tot zout hier lager is dan in bloed.

Oplossingen van sterke zuren en logen diezwakke reacties hebben, een variabele pH hebben. Maar het mengsel van azijnzuur met zijn zout behoudt een stabiele waarde. Zelfs als u er zuur of base aan toevoegt, verandert de zuur-base-balans niet. Beschouw als voorbeeld de acetaatbuffer, die bestaat uit het zuur CH3COOH en zijn zouten CH3SOO.Als je een sterk zuur toevoegt, zal de basis van het zout de H + -ionen binden en in azijnzuur veranderen. Een afname van het gehalte aan zoutanionen wordt gecompenseerd door een toename van zuurmoleculen. Als resultaat is er een kleine verandering in de verhouding van zuur tot zijn zout, zodat de pH vrijwel onmerkbaar verandert.

Wanneer zuur of basisch in het bloed komtvoedselbuffer zorgt voor een constante pH-waarde totdat het ingenomen voedsel niet wordt uitgescheiden of gebruikt in metabolische processen. Er zijn vier buffers in menselijk bloed, die elk uit twee delen bestaan: een zuur en zijn zout, evenals een sterke alkali.
Het buffereffect is te wijten aan het feit dat hetbindt en neutraliseert ionen die bij de bijbehorende samenstelling horen. Omdat het lichaam in de natuur vooral ondergeoxideerde stofwisselingsproducten tegenkomt, zijn de eigenschappen van de buffer meer zuur dan alkalisch.
Elk buffersysteem heeft zijn eigen werkingsprincipe.Wanneer de pH-waarde onder 7,0 zakt, begint hun krachtige activiteit. Ze beginnen overtollige vrije waterstofionen te binden en vormen zo complexen die zuurstof verplaatsen. Het reist op zijn beurt naar het spijsverteringsstelsel, de longen, de huid, de nieren, enzovoort. Dergelijk transport van zure en alkalische producten vergemakkelijkt het lossen en verwijderen ervan.
In het menselijk lichaam zijn er slechts vier bufferssystemen spelen een belangrijke rol bij het handhaven van het zuur-base-evenwicht, maar er bestaan ook andere buffers, bijvoorbeeld een acetaatbuffersysteem, dat een zwak zuur (donor) en zijn zout (acceptor) heeft. Het vermogen van deze mechanismen om veranderingen in pH te weerstaan wanneer zuur of zout in de bloedbaan terechtkomt, is beperkt. Ze behouden alleen een zuur-base-evenwicht wanneer een sterk zuur of een sterke base in een bepaalde hoeveelheid wordt geleverd. Als deze wordt overschreden, zal de pH drastisch veranderen, het buffersysteem zal ophouden te functioneren.
De buffers van bloed en erytrocyten zijn verschillendefficiëntie. In het laatste geval is het hoger, omdat er een hemoglobinebuffer is. De afname van het aantal ionen vindt plaats in de richting van de cel naar het extracellulaire medium en vervolgens naar het bloed. Dit suggereert dat het bloed de grootste buffercapaciteit heeft en de intracellulaire omgeving de kleinste.
Tijdens het metabolisme verschijnen zuren in cellen,die in de intercellulaire vloeistof terechtkomen. Dit gebeurt des te gemakkelijker, des te meer ervan verschijnen in de cellen, aangezien een teveel aan waterstofionen de permeabiliteit van het celmembraan verhoogt. Weten we al classificatie van buffersystemen... In erytrocyten zijn ze effectievereigenschappen, aangezien hier nog steeds collageenvezels een rol spelen, die door zwelling op de ophoping van zuur reageren, dit absorberen en uit waterstofionen erytrocyten vrijmaken. Dit vermogen is te danken aan de eigenschap van absorptie.
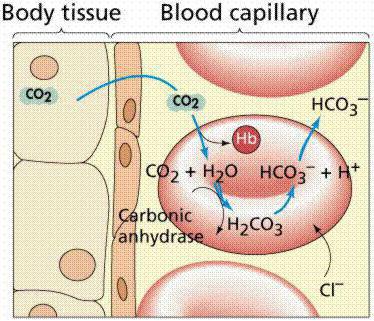
Alle mechanismen die in het lichaam zittenzijn met elkaar verbonden. Bloedbuffers bestaan uit verschillende systemen, waarvan de bijdrage aan het handhaven van het zuur-base-evenwicht verschillend is. Wanneer bloed de longen binnendringt, ontvangt het zuurstof door het in erytrocyten te binden met hemoglobine, waardoor oxyhemoglobine (zuur) wordt gevormd, dat de pH-waarde op peil houdt. Met behulp van koolzuuranhydrase is er een parallelle zuivering van het bloed van de longen van kooldioxide, dat in erytrocyten wordt gepresenteerd in de vorm van zwak dibasisch koolzuur en carbaminohemoglobine, en in het bloed - door kooldioxide en water.
Met een afname van het aantal zwakke erytrocytendibasisch koolzuur, het dringt vanuit het bloed in de erytrocyt en het bloed wordt gezuiverd van kooldioxide. Aldus gaat zwak dibasisch koolzuur constant van de cellen naar het bloed, en inactieve chloride-anionen komen de erytrocyten binnen vanuit het bloed om hun neutraliteit te behouden. Als gevolg hiervan is de omgeving in rode bloedcellen zuurder dan in plasma. Alle buffersystemen worden gerechtvaardigd door de proton-donor-acceptorverhouding (4:20), die verband houdt met de kenmerken van het metabolisme van het menselijk lichaam, dat een groter aantal zure producten vormt dan alkalische. Heel belangrijk hierbij is de indicator van de zuurbuffercapaciteiten.

Zuur-base-evenwicht gehandhaafd door buffersen metabolische transformaties in lichaamsweefsels. Dit wordt geholpen door biochemische en fysicochemische processen. Ze dragen bij aan het verlies van de zuur-base-eigenschappen van metabolische producten, hun binding, de vorming van nieuwe verbindingen die snel uit het lichaam worden verwijderd. Zo wordt een grote hoeveelheid melkzuur uitgescheiden in glycogeen, organische zuren worden geneutraliseerd door natriumzouten. Sterke zuren en basen lossen op in lipiden en organische zuren ondergaan oxidatie om koolzuur te vormen.
Op deze manier het buffersysteem is eerste helper bij normalisatiezuur-base-evenwicht in het menselijk lichaam. PH-stabiliteit is nodig voor het normaal functioneren van biologische moleculen en structuren, organen en weefsels. Onder normale omstandigheden houden bufferprocessen een evenwicht in stand tussen het verschijnen en verwijderen van waterstofionen en kooldioxide, wat helpt om een constant pH-niveau in het bloed te behouden.
Als de buffersystemen falen, daneen persoon ontwikkelt pathologieën zoals alkalose of acidose. Alle buffersystemen zijn met elkaar verbonden en gericht op het handhaven van een stabiel zuur-base-evenwicht. In het menselijk lichaam wordt constant een groot aantal zure producten gevormd, wat overeenkomt met dertig liter sterk zuur.
De persistentie van reacties in het lichaam is verzekerdkrachtige buffers: fosfaat, eiwit, hemoglobine en bicarbonaat. Er zijn andere buffersystemen, maar deze zijn de belangrijkste en meest noodzakelijke voor een levend organisme. Zonder hun hulp zal een persoon verschillende pathologieën beginnen te ontwikkelen die tot coma of overlijden kunnen leiden.


























