
الحلول هي كتلة متجانسة أو خليط يتكون من مادتين أو أكثر ، حيث تعمل مادة واحدة كمذيب ، والأخرى كجزيئات قابلة للذوبان.
هناك نظريتان لتفسير المنشأالحلول: الكيميائية ، مؤسسها هو Mendeleev ، والبدنية ، التي اقترحها الفيزيائيان الألماني والسويسري Ostwald و Arrhenius. وفقا لتفسير Mendeleev ، تصبح مكونات المذيب والمواد الذائبة مشاركين في تفاعل كيميائي مع تكوين مركبات غير مستقرة من هذه المكونات أو الجزيئات نفسها.
Физическая же теория отрицает химическое التفاعل بين جزيئات الذوبان والمواد المذابة ، موضحا عملية تشكيل المحاليل كتوزيع موحد للجسيمات (جزيئات ، أيونات) من مذيب بين جسيمات مادة مذابة بسبب ظاهرة فيزيائية تسمى الانتشار.
في الوقت الحالي ، لا يوجد نظام تصنيف واحد للحلول ، ومع ذلك ، يمكن أن يتم تجميع أنواع الحلول وفقًا لمعايير أهمها:
I) وفقًا لحالة انبعاث التجميع: المحاليل الصلبة والغازية والسائلة.
II) حجم جزيئات المذاب: الغروية والحقيقية.
III) وفقًا لدرجة تركيز جزيئات المادة المذابة في المحلول: المشبعة ، غير المشبعة ، المركزة ، المخففة.
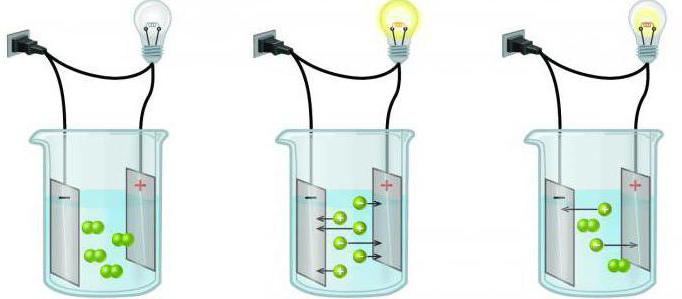
رابعا) من خلال القدرة على إجراء التيار الكهربائي: الشوارد وغير الشوارد.
V) حسب الغرض والنطاق: الكيميائية والطبية والبناء والحلول الخاصة ، الخ
تصنيف الحلول حسب حالة التجميعيتم إعطاء المذيب بالمعنى الواسع للكلمة. يُعتبر محاليل للمواد السائلة (علاوة على ذلك ، يمكن أن تعمل كل من العناصر السائلة والصلبة كمادة مذابة) ، ولكن إذا أخذنا في الاعتبار حقيقة أن المحلول هو نظام متجانس من مادتين أو أكثر ، فمن المنطقي تمامًا التعرف على المحاليل الصلبة الغازية. تعتبر المحاليل الصلبة مخاليط ، على سبيل المثال ، للعديد من المعادن ، والمعروفة أكثر باسم السبائك. الأنواع الغازية من المحاليل عبارة عن خليط من عدة غازات ، على سبيل المثال ، الهواء المحيط بنا ، والذي يمثل كمركب من الأكسجين والنيتروجين وثاني أكسيد الكربون.

أنواع الحلول حسب حجم الجزيئات الذائبةتشمل الحلول الحقيقية والأنظمة الغروية. في المحاليل الحقيقية ، ينقسم المذاب إلى جزيئات صغيرة أو ذرات قريبة من جزيئات المذيبات. في هذه الحالة ، تحتفظ الأنواع الحقيقية من المحاليل بالخواص الأصلية للمذيب ، وتحولها قليلاً فقط تحت تأثير الخواص الفيزيائية الكيميائية للعنصر المضاف إليها. على سبيل المثال: عندما يذوب الملح أو السكر في الماء ، يبقى الماء في نفس حالة التجميع ونفس الاتساق ، من نفس اللون تقريبًا ، يتغير طعمه فقط.

تختلف الحلول الغروية عن الحلول العادية.أن المكون الإضافي لا يتحلل تمامًا ، مع الحفاظ على الجزيئات المعقدة والمركبات التي تكون أحجامها أكبر بكثير من جزيئات المذيب ، تتجاوز قيمة 1 نانومتر.
يمكن إضافة كميات مختلفة من العنصر المراد إذابته إلى نفس كمية المذيب ؛ سيكون لدينا حلول بتركيزات مختلفة عند الإخراج. ندرج أهمها:
تتحلل بعض المواد في المحاليل إلىأيونات قادرة على إجراء التيار الكهربائي. تسمى هذه الأنظمة المتجانسة الشوارد. تحتوي هذه المجموعة على الأحماض ومعظم الأملاح. ويطلق على الحلول التي لا توصل التيار الكهربائي عادة غير اللاإلكتروليتات (جميع المركبات العضوية تقريبًا).
الحلول لا غنى عنها في جميع قطاعات الاقتصاد ، التي خلقت خصوصيتها أنواعًا من الحلول الخاصة مثل الطبية والبناء والكيميائية وغيرها.
الحلول الطبية هي مزيجالمستحضرات في شكل مراهم ، معلقات ، مخاليط ، حلول التسريب والحقن ، وأشكال جرعات أخرى تستخدم للأغراض الطبية لعلاج والوقاية من الأمراض المختلفة.

تشمل أنواع الحلول الكيميائيةمجموعة كبيرة ومتنوعة من المركبات المتجانسة المستخدمة في التفاعلات الكيميائية: الأحماض والأملاح. يمكن أن تكون هذه المحاليل ذات أصل عضوي أو غير عضوي ، مائي (مياه البحر) أو لا مائي (يعتمد على البنزين ، الأسيتون ، إلخ) ، سائل (فودكا) أو صلب (نحاس). وجدوا تطبيقهم في مختلف قطاعات الاقتصاد الوطني: الكيميائية والغذائية وصناعة النسيج.
تختلف أنواع قذائف الهاون في الاتساق اللزج والسميك ، وهذا هو السبب في أن اسم الخليط أكثر ملاءمة لهم.



























