
Termodynamika jako samostatná sekceFyzikální věda vznikla v první polovině 19. století. Udeřilo století aut. Průmyslová revoluce vyžadovala studium a pochopení procesů spojených s fungováním tepelných motorů. Na samém začátku strojní éry si mohli jediní vynálezci dovolit používat pouze intuici a „metodu poke“. Neexistoval žádný veřejný pořádek pro objevy a vynálezy, nikdo si ani nedokázal představit, že by mohly být užitečné. Když se však základem výroby staly tepelné (a o něco později elektrické) stroje, situace se změnila. Vědci nakonec vyřešili terminologický zmatek, který vládl až do poloviny XIX. Století, rozhodování o tom, co nazývat energií, jakou silou, co - impulsem.
Začněme dobře známými informacemi.Klasická termodynamika je založena na několika postulátech (principech), zavedených postupně v celém XIX století. To znamená, že tato ustanovení nejsou prokazatelná v jeho rámci. Byly formulovány jako výsledek syntézy empirických dat.
Prvním začátkem je uplatňování zákona o ochraně přírodyenergie popisující chování makroskopických systémů (sestávající z velkého počtu částic). Stručně lze říci, že: dodávka vnitřní energie izolovaného termodynamického systému vždy zůstává konstantní.
Smyslem druhého termodynamického zákona je určit směr, jakým se procesy v takových systémech vyskytují.
Třetí princip umožňuje přesně určit množství, jako je entropie. Podívejme se na to podrobněji.
Formulace druhého termodynamického zákona bylanavrhl v roce 1850 Rudolf Clausius: „spontánní přenos tepla z méně zahřátého těla na teplejší není možný“. Současně Clausius zdůraznil zásluhy Sadi Carnota, který již v roce 1824 stanovil, že podíl energie, kterou lze proměnit v tepelný motor, závisí pouze na teplotním rozdílu mezi ohřívačem a lednicí.

S dalším vývojem druhého začátkutermodynamika Clausius zavádí pojem entropie - měřítko množství energie, které nevratně přechází do formy nevhodné pro přeměnu v práci. Clausius toto množství vyjádřil vzorcem dS = dQ / T, kde dS, což určuje změnu entropie. Zde:
dQ je změna tepla;
T je absolutní teplota (stejná jako teplota naměřená v kelvinech).
Jednoduchý příklad:při běžícím motoru se dotkněte kapoty automobilu. Je jasně teplejší než životní prostředí. Ale motor vozu není určen k ohřevu kapoty nebo vody v chladiči. Při přeměně chemické energie benzínu na teplo, a poté na mechanickou, funguje užitečná práce - otáčí hřídelí. Většina generovaného tepla je však ztracena, protože z ní nelze získat užitečnou práci a to, co letí z výfukového potrubí, už není benzín. V tomto případě je tepelná energie ztracena, ale nezmizí, ale rozptyluje (rozptyluje). Horká kapuce se samozřejmě ochlazuje a každý cyklus válců v motoru jí opět dodává teplo. Systém se tak snaží dosáhnout termodynamické rovnováhy.
Clausius vyvodil obecný princip pro druhý začátektermodynamika ve vzorci dS ≥ 0. Jeho fyzikální význam lze definovat jako „neklesající“ entropii: v reverzibilních procesech se nemění, v nevratných procesech se zvyšuje.
Je třeba poznamenat, že všechny skutečné procesynezvratný. Termín „neklesající“ odráží pouze skutečnost, že do úvahy je také zahrnuta teoreticky možná idealizovaná verze. To znamená, že se zvyšuje množství nepřístupné energie v jakémkoli spontánním procesu.
Max Planck významně přispěl k rozvojitermodynamika. Kromě práce na statistické interpretaci druhého zákona se aktivně podílel na postulování třetího termodynamického zákona. První formulace patří Walterovi Nernstovi a odkazuje na rok 1906. Nernstova věta zvažuje chování rovnovážného systému při teplotě inklinující k absolutní nule. První a druhý princip termodynamiky znemožňuje zjistit, co bude entropie za těchto podmínek.

Při T = 0 K je energie nulová, částice systémuzastavit chaotické termální pohyby a vytvořit uspořádanou strukturu, krystal s termodynamickou pravděpodobností rovnou jednotě. To znamená, že entropie také zmizí (níže zjistíme, proč k tomu dochází). Ve skutečnosti to dokonce dělá o něco dříve, z čehož vyplývá, že chlazení jakéhokoli termodynamického systému, těla na absolutní nulu je nemožné. Teplota se k tomuto bodu libovolně přiblíží, ale nedosáhne ho.
Clausius takto zobecnil a zformuloval první a druhý princip termodynamiky: celková energie jakéhokoli uzavřeného systému vždy zůstává konstantní a celková entropie se postupem času zvyšuje.
První část tohoto prohlášení je zakázánastroj s trvalým pohybem prvního druhu - zařízení, které vykonává práci bez přílivu energie z vnějšího zdroje. Druhá část rovněž zakazuje stroj na neustálý pohyb druhého druhu. Takový stroj převede energii systému do provozu bez náhrady entropie, aniž by došlo k porušení zákona o zachování. Bylo by možné odčerpat teplo z rovnovážného systému, například smažit smažená vejce nebo nalít ocel pomocí energie tepelného pohybu molekul vody za jeho chlazení.
Druhý a třetí princip termodynamiky zakazuje věčný pohybový stroj druhého druhu.
Bohužel, nic nemůže být získáno z přírody, nejen za nic, musíte také zaplatit provizi.

Ve vědě existuje jen málo konceptů, které evokovalyexistuje tolik nejasných emocí nejen mezi širokou veřejností, ale také mezi samotnými vědci, kolik entropie představovalo. Fyzici, a především sám Clausius, téměř okamžitě extrapolovali zákon nesnižování nejprve na Zemi a poté na celý vesmír (proč ne, protože to lze také považovat za termodynamický systém). V důsledku toho začalo být fyzické množství, důležitý prvek výpočtů v mnoha technických aplikacích, vnímáno jako ztělesnění nějakého univerzálního zla, které ničí jasný a dobrý svět.
Mezi vědci jsou také takové názory:protože podle druhého termodynamického zákona entropie nezvratně roste, dříve či později se veškerá energie vesmíru rozpadne do rozptýlené formy a dojde k „tepelné smrti“. Co si můžete užít? Například Clausius se netroufl zveřejnit své závěry několik let. Hypotéza „tepelné smrti“ samozřejmě vznesla mnoho námitek. I dnes existují vážné pochybnosti o jeho správnosti.
V roce 1867 James Maxwell, jeden z autorůMolekulárně-kinetická teorie plynů ve velmi vizuálním (byť fiktivním) experimentu prokázala zřejmý paradox druhého termodynamického zákona. Stručně lze shrnout následující zkušenost.
Nechť je nádoba s plynem.Molekuly v něm se pohybují náhodně, jejich rychlosti se mírně liší, ale průměrná kinetická energie je v celé cévě stejná. Nyní rozdělte plavidlo přepážkou na dvě izolované části. Průměrná rychlost molekul v obou polovinách nádoby zůstane stejná. Rozdělení je chráněno malým démonem, který umožňuje rychlejším „horkým“ molekulám proniknout do jedné části a pomalejší „studenou“ na druhou. V důsledku toho se plyn zahřívá v první polovině a ochlazuje se ve druhé polovině, tj. Ze stavu termodynamické rovnováhy systém přejde na rozdíl teplotních potenciálů, což znamená snížení entropie.
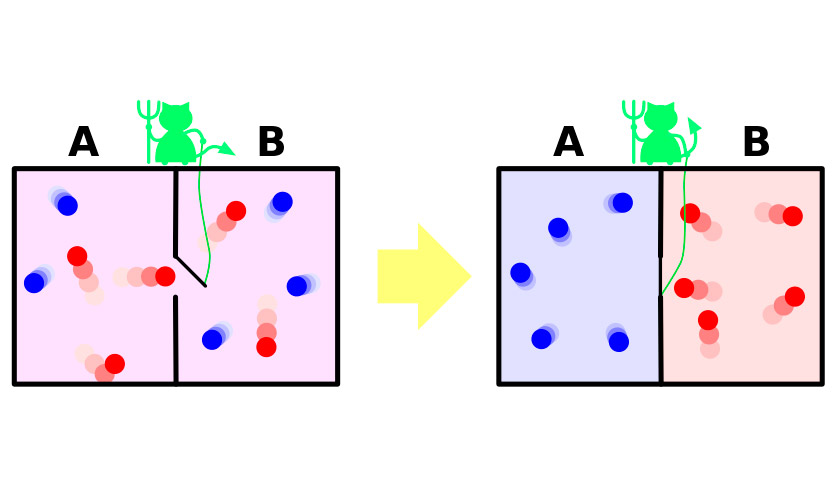
Celý problém je, že v experimentu systémdělá tento přechod není spontánní. Přijímá energii zvenčí, díky níž se oddíl otevírá a zavírá, nebo systém nezbytně obsahuje démona, který svou energii utratí na povinnosti strážce. Zvýšení entropie démona hojně pokryje jeho pokles plynu.
Vezměte sklenici vody a nechte ji na stole.Sledování skla není nutné, stačí se po chvíli vrátit a zkontrolovat stav vody v něm. Uvidíme, že se jeho množství snížilo. Pokud necháte sklenici po dlouhou dobu, nebude v ní vůbec žádná voda, protože se vše vypaří. Na samém začátku procesu byly všechny molekuly vody v určité oblasti prostoru ohraničené stěnami skla. Na konci experimentu se rozptýlili po místnosti. V objemu místnosti mají molekuly mnohem více příležitostí ke změně umístění bez jakýchkoli důsledků pro stav systému. Nebudeme schopni je shromáždit v pájeném „týmu“ a odvézt je zpět do sklenice, abychom pili vodu ze zdravotních důvodů.

To znamená, že se systém vyvinulstav s vyšší entropií. Na základě druhého zákona termodynamiky je entropie nebo disperze částic v systému (v tomto případě molekuly vody) nevratná. Proč je to tak?
Clausius neodpověděl na tuto otázku a nikdo jiný to nemohl udělat před Ludwigem Boltzmannem.
V roce 1872 se tento vědec představil do vědystatistická interpretace druhého termodynamického zákona. Makroskopické systémy, s nimiž se termodynamika zabývá, jsou ve skutečnosti tvořeny velkým počtem prvků, jejichž chování se řídí statistickými zákony.
Vraťme se k molekulám vody.Náhodně létají po místnosti, mohou zaujímat různé polohy, mají určité rozdíly v rychlosti (molekuly se neustále střetávají mezi sebou as ostatními částicemi ve vzduchu). Každá varianta stavu systému molekul se nazývá microstate a existuje velké množství takových variant. Po implementaci naprosté většiny možností se stav makra systému nijak nezmění.
Číslo spojuje slavný vztah S = k lnWmožné způsoby, jak lze vyjádřit určitý makrostát termodynamického systému (W), s jeho entropií S. Hodnota W se nazývá termodynamická pravděpodobnost. Konečná podoba tohoto vzorce byla dána Maxem Planckem. Koeficient k je extrémně malý (1,38 × 10)−23 J / K), který charakterizuje vztah mezi energií a teplotou, Planck jmenoval Boltzmannovu konstantu na počest vědce, který jako první navrhl statistickou interpretaci druhého termodynamického zákona.

Je zřejmé, že W je vždy přirozené číslo 1, 2, 3,… N(neexistuje zlomkový počet způsobů). Pak logaritmus W, a tedy entropie, nemůže být negativní. U jediného možného mikrostátu pro systém se entropie stane nulou. Pokud se vracíme zpět do našeho skla, tento postulát lze znázornit následovně: molekuly vody, které se náhodně rozbíhají po místnosti, se vracejí zpět do skla. Současně každý přesně opakoval svou cestu a zaujal stejné místo ve skle jako před letem. Provedení této možnosti, ve které je entropie nulová, nic nezakazuje. Jen počkejte na implementaci takové mizivě malé pravděpodobnosti nestojí za to. Toto je jeden příklad něčeho, co lze udělat pouze teoreticky.
Takže molekuly chaoticky létají po místnosti.různé způsoby. Neexistuje žádný vzor v jejich uspořádání, v systému není žádný pořádek, bez ohledu na to, jak měníte varianty microstates, není možné dohledat žádnou srozumitelnou strukturu. Ve skle to bylo stejné, ale kvůli omezenému prostoru molekuly aktivně nezměnily své postavení.
Chaotický, neuspořádaný stav systémujako nejpravděpodobnější odpovídá jeho maximální entropii. Voda ve sklenici je příkladem stavu nižší entropie. Přechod na něj z chaosu rovnoměrně rozloženého po místnosti je prakticky nemožný.
Uveďme příklad, který je pro nás všechny srozumitelnější -uklidit nepořádek v domě. Abychom dali všechno na své místo, musíme také vynaložit energii. V průběhu této práce se zahřívá (to znamená, že nemrzneme). Ukazuje se, že entropie může být prospěšná. Tohle je ten případ. Ještě více lze říci: entropie a díky ní druhý vesmír termodynamiky (spolu s energií) řídí vesmír. Pojďme se znovu podívat na reverzibilní procesy. Takto by svět vypadal, kdyby nebyl pro entropii: žádný vývoj, žádné galaxie, hvězdy, planety. Žádný život ...

Další informace o „tepelné smrti“.Jsou dobré zprávy. Protože podle statistické teorie jsou „zakázané“ procesy ve skutečnosti nepravděpodobné, dochází v termodynamicky rovnovážném systému k fluktuacím - spontánnímu porušování druhého zákona o termodynamice. Mohou být tak velké, jak chcete. Pokud je do termodynamického systému zahrnuta gravitace, nebude již distribuce částic chaoticky stejnoměrná a nebude dosaženo stavu maximální entropie. Navíc se vesmír nemění, stálý, stacionární. Samotná formulace otázky „tepelné smrti“ proto nemá smysl.


























