
Řešení jsou homogenní systémy, kteréobsahují dvě nebo více komponent, stejně jako produkty, které jsou výsledkem interakce těchto komponent. Mohou být v pevném, kapalném nebo plynném stavu. Podívejme se na stav agregátních roztoků kapaliny. Jejich složení zahrnuje rozpouštědlo a rozpuštěnou látku (poslední je méně).
Solutivní vlastnosti řešení jsou jejichvlastnosti, které jsou přímo závislé pouze na použitém rozpouštědle a koncentraci roztoku. Jsou také nazývány kolektivní nebo kolektivní. Koligativní vlastnosti jsou uvedeny ve směsích, ve kterých nedochází k žádné interakci mezi chemickou povahou jejich složek. Kromě toho vzájemné působení sil mezi částicemi a částice rozpouštědlo-rozpouštědlo a rozpuštěné látky v něm jsou v ideální řešení.
Kolligativní vlastnosti roztoků:
1) Tlak par je nižší než roztok nad rozpouštědlem.
2) Krystalizace roztoku probíhá při teplotě nižší než je teplota krystalizace rozpouštědla ve své čisté formě.
3) Varu roztoku se vyskytuje při vyšší teplotě než varu samotného rozpouštědla.
4) Fenomén osmózy.

Uvažujme separační vlastnosti.
Rovnováha na hranici fází v uzavřeném systému:Tekuté páry jsou charakterizovány nasyceným parovým tlakem. Vzhledem k tomu, že v roztoku je část povrchové vrstvy naplněna molekulami rozpuštěné látky, rovnováha se dosáhne při nižším tlaku par.
Druhá koligatická vlastnost je pokleskrystalizační teplota roztoku ve srovnání s rozpouštědlem je způsobena tím, že částice rozpuštěné látky interferují při konstrukci krystalů a zabraňují tak krystalizaci s klesající teplotou.
Teplota varu směsi je vyšší než rozpouštědločistá forma, protože rovnováha atmosférického tlaku a tlak nasycené páry je dosaženo větším zahřátím, protože některé molekuly rozpouštědla jsou spojeny s částicemi rozpuštěné látky.

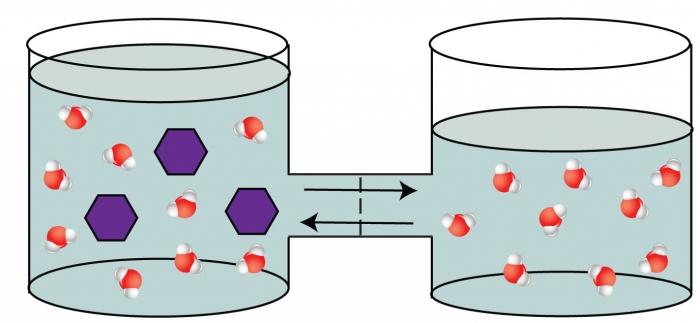
Čtvrtou tajnou vlastností řešení je fenomén osmózy.
Fenomén osmózy je schopnost rozpouštědlamigrují septou, která je propustná pro některé částice (molekuly rozpouštědla) a neproniknutelná ostatním (molekuly hmoty jsou rozpuštěny). Tato přepážka rozděluje roztok s vysokým obsahem rozpuštěné látky z méně koncentrovaného roztoku. Příkladem takové polopropustné oddílu, může sloužit jako membránou živé buňky, skotu, apod bublina. Osmózy jev způsobený koncentrace vyrovnáním na obou stranách od sebe odděleny membránou, která je termodynamicky výhodnější pro systém. V důsledku přemístění rozpouštědla do koncentrovanějšího roztoku se v této části nádoby pozoruje zvýšení tlaku. Tento přetlak byl nazýván osmotickým.
Matematicky lze charakterizovat vlastnost řešení neelektrolytů pomocí rovnic:
Δ Tkip = Skica ∙ Sm;
Δ Tcr. = Kzam ∙ Sm;
π = CRT.
Koligativní vlastnosti v číselných termínechliší se roztoky elektrolytů a roztoků neelektrolytů. Nejprve jsou poněkud větší. To je způsobeno tím, že jde o elektrolytickou disociaci a počet částic se výrazně zvyšuje.
Solutivní vlastnosti řešení jsou široképoužití v domácnosti a při práci, např. jev osmózy se používá k výrobě čisté vody. V živých organizmech je mnoho systémů postaveno také na koligatických vlastnostech řešení (například růst rostlinných buněk).


























