
Les caractéristiques de la structure de l'acétylène influent sur ses propriétés, sa production et son utilisation. Le symbole de la composition de la substance - C2H2 - Ceci est sa formule la plus simple et grossière.L'acétylène est formé de deux atomes de carbone, entre lesquels se produit une triple liaison. Sa présence reflète les différents types de formules et de modèles de la molécule d'éthine, permettant de comprendre le problème de l'influence de la structure sur les propriétés d'une substance.
Les hydrocarbures alcynes, ou acétylène, sontacyclique, non saturé. La chaîne d'atomes de carbone n'est pas fermée, elle contient des liaisons simples et multiples. La composition des alcynes reflète la formule composite CM.X2n - 2. Dans les molécules de substances de cette classe est présenteune ou plusieurs liaisons triples. Les composés d'acétylène sont insaturés. Cela signifie qu'une seule valence du carbone est due à l'hydrogène. Les trois liaisons restantes sont utilisées dans l'interaction avec d'autres atomes de carbone.
Le premier - et le représentant le plus célèbreles alcynes - acétylène ou éthin. Le nom trivial de la substance provient du mot latin "acetum" - "vinaigre" et du grec - "hyle" - "arbre". L'ancêtre de la série homologue a été découvert en 1836 au cours d'expériences chimiques. La substance a ensuite été synthétisée à partir de charbon et d'hydrogène par E. Devi et M. Berthelot (1862). À la température ordinaire et à la pression atmosphérique normale, l'acétylène est à l'état gazeux. C'est un gaz incolore, inodore, peu soluble dans l'eau. L'étine est plus facile à dissoudre dans l'éthanol et l'acétone.

Aetin est le membre le plus simple de sa série homologue, sa composition et sa structure reflètent les formules:
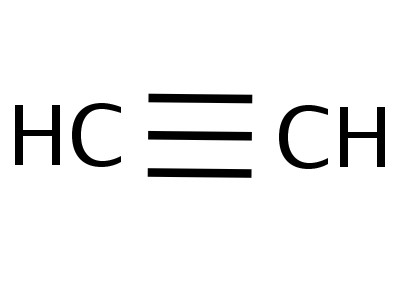
Formules montrant la distribution des électrons,a servi de base à la création de modèles orbitaux et atomiques, formules spatiales de molécules (stéréochimiques). Dès la fin du XVIIIe siècle, les modèles à roulement à billes se sont répandus - par exemple, des billes de différentes tailles et couleurs, désignant le carbone et l'hydrogène, qui forment l'acétylène. La formule développée de la molécule est représentée sous forme de bâtonnets, symbolisant les liaisons chimiques et leur nombre sur chaque atome.
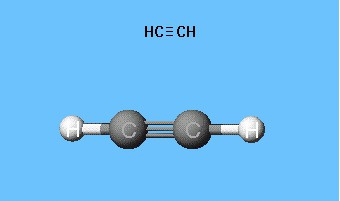
Le modèle de bâton de rouleau d'acétylène reproduitangles de liaison égaux à 180 °, mais les distances internucléaires dans la molécule sont réfléchies approximativement. Les vides entre les billes ne créent pas une idée du remplissage de l'espace des atomes avec la densité électronique. L'inconvénient est éliminé dans les modèles de Dreyding, qui désignent les noyaux atomiques non pas par des billes, mais par les points d'attache des bâtonnets les uns aux autres. Les modèles volumétriques modernes donnent une idée plus vivante des orbitales atomiques et moléculaires.
Le carbone à l'état excité contient trois orbitales p et une avec des électrons non appariés. Avec la formation de méthane (CH4) они принимают участие в создании равноценных liaisons avec des atomes d'hydrogène. Le célèbre chercheur américain L. Pauling a développé la théorie de l'état hybride des orbitales atomiques (AO). L'explication du comportement du carbone dans les réactions chimiques consiste à aligner l'AO sur la forme et l'énergie, la formation de nouveaux nuages. Les orbitales hybrides donnent des connexions plus fortes, la formule devient plus stable.
Les atomes de carbone dans la molécule d’acétylène, contrairement àle méthane subit une hybridation sp. Forme et énergie mélangent les électrons s et p. Deux orbitales sp apparaissent à un angle de 180 °, dirigées sur les côtés opposés du noyau.

Nuages d'électrons de carbone dans l'acétylène hybrideparticiper à la création de liaisons σ avec les mêmes atomes voisins et avec l'hydrogène par paires C - H. Il reste deux orbitales p non hybrides perpendiculaires entre elles. Dans la molécule d'éthine, ils sont impliqués dans la formation de deux liaisons π. En même temps que σ, une triple liaison se crée, ce qui se reflète dans la formule structurelle. L'acétylène diffère de l'éthane et de l'éthylène par la distance entre les atomes. La triple liaison est plus courte que la double, mais a une grande réserve d'énergie, est plus durable. La densité maximale des liaisons σ et π se situe dans des régions perpendiculaires, ce qui conduit à la formation d'un nuage d'électrons cylindrique.
La molécule d'éthine a une forme linéaire qui réussitreflète la formule chimique de l'acétylène - H - C≡C - H. Les atomes de carbone et d'hydrogène forment une droite, entre eux il y a 3 liaisons σ et 2 π. La libre circulation, la rotation le long de l'axe CC est impossible, ceci est empêché par la présence de liaisons multiples. Autres caractéristiques de triple liaison:
A titre de comparaison: dans les molécules d’éthane et d’éthylène, la longueur des liaisons chimiques simples et doubles est respectivement de 1,54 et 1,34 nm, l’énergie de rupture CC est de 348 kJ / mol, C = C est de 614 kJ / mol.

L'acétylène est le représentant le plus simple des alcynes dont les molécules possèdent également une triple liaison. Propine CH3C≡CH est un homologue de l'acétylène. La formule du troisième représentant alkyn - butyne-1 - CH3CH2С≡СН. L'acétylène est le nom trivial d'éthine. La nomenclature systématique des alkyns est soumise aux règles de l'IUPAC:

L'étine et la propyne n'ont pas d'isomères triplesconnexions, ils apparaissent, à commencer par la butine. Les isomères squelettiques carbonés du pentin et les homologues suivants. En ce qui concerne la triple liaison, l'isomérie spatiale des hydrocarbures acétyléniques n'apparaît pas.
Les 4 premiers homologues de l'éthine sont des gaz peu solubles dans l'eau. Acétylène C hydrocarbures5 - C15 - des liquides. Les solides sont les homologues de l’éthine, à partir de l’hydrocarbure C17. La nature chimique des alcynes connaîteffet de triple liaison significatif. Les hydrocarbures de ce type sont plus actifs que l’éthylène, fixent diverses particules. Cette propriété est basée sur l'utilisation répandue d'ethin dans l'industrie et la technologie. Lors de la combustion de l'acétylène, une grande quantité de chaleur est dégagée. Elle est utilisée pour le coupage au gaz et le soudage des métaux.


























