
Avant d'analyser comment fabriquer des isomères d'hydrocarbures saturés, nous révélons les caractéristiques de cette classe de substances organiques.
De nombreux cours se distinguent en chimie organique.CxHy. Chacun a sa propre formule générale, série homologue, réactions qualitatives, application. Les hydrocarbures saturés de la classe des alcanes sont caractérisés par des liaisons simples (sigma). La formule générale pour cette classe de substances organiques est CnH2n + 2. Cela explique les propriétés chimiques de base: substitution, combustion, oxydation. L'attachement n'est pas caractéristique des paraffines, car les liaisons dans les molécules de ces hydrocarbures sont uniques.

Un phénomène tel que l'isomérisme expliquevariété de substances organiques. On entend par isomérie un phénomène dans lequel il existe plusieurs composés organiques ayant la même composition quantitative (le nombre d'atomes dans une molécule), mais leur disposition différente dans la molécule. Les substances résultantes sont appelées isomères. Ils peuvent être représentatifs de plusieurs classes d'hydrocarbures, et donc différer par leurs propriétés chimiques. Un composé différent dans la molécule d'alcanes des atomes de carbone entraîne l'apparition d'une isomérie structurale. Comment fabriquer des isomères d'alcanes? Il existe un certain algorithme selon lequel il est possible de représenter les isomères structuraux de cette classe de substances organiques. Il existe une possibilité similaire avec seulement quatre atomes de carbone, c'est-à-dire avec la molécule de butane C4H10.
Afin de comprendre comment faire des formulesisomères, il est important d'avoir une idée de ses types. S'il y a des atomes égaux à l'intérieur de la molécule en nombres égaux, qui sont situés dans l'espace dans un ordre différent, nous parlons d'isomérie spatiale. Sinon, cela s'appelle le stéréoisomérisme. Dans une telle situation, l'utilisation de formules structurelles seules ne suffira pas, l'utilisation de projections spéciales ou de formules spatiales sera nécessaire. Les hydrocarbures marginaux, à commencer par H3C - CH3 (éthane), ont des configurations spatiales différentes. Cela est dû à la rotation à l'intérieur de la molécule à la liaison C - C. C'est une simple liaison σ qui crée l'isomérie conformationnelle (rotationnelle).

Parlons de la façon de fabriquer des isomères d'alcanes.La classe a une isomérie structurelle, c'est-à-dire que l'atome de carbone forme différentes chaînes. Sinon, la possibilité de changer la position dans la chaîne des atomes de carbone est appelée isomérie du squelette carboné.

Alors, comment laisser les isomères pour une substance,ayant la composition de C7H16? Pour commencer, vous pouvez disposer tous les atomes de carbone dans une longue chaîne, ajouter pour chacun un certain nombre d'atomes C. Combien? Étant donné que la valence du carbone est de quatre, les atomes externes auront trois atomes d'hydrogène et les atomes internes en auront deux. La molécule résultante a une structure linéaire, un tel hydrocarbure est appelé n - heptane. La lettre «n» fait référence au squelette carboné droit dans un hydrocarbure donné.
Maintenant, nous changeons l'arrangement des atomes de carbone,En «raccourcissant» la chaîne carbonée directe en C7H16. Il est possible de fabriquer des isomères sous forme développée ou réduite. Considérez la deuxième option. Premièrement, nous plaçons un atome C sous la forme d'un radical méthyle dans différentes positions.
Cet isomère d'heptane a le nom chimique suivant: 2-méthylhexane. Maintenant, nous «déplaçons» le radical vers le prochain atome de carbone. L'hydrocarbure saturé résultant est appelé: 3-méthylhexane.
Si nous continuons à déplacer le radical,la numérotation commencera sur le côté droit (un radical hydrocarboné est situé plus près du début), c'est-à-dire que nous obtiendrons l'isomère que nous avons déjà. Par conséquent, en réfléchissant à la façon de faire des formules d'isomères pour le matériau de départ, nous allons essayer de rendre le squelette encore plus «court».
Les deux autres carbones peuvent être représentés par deux radicaux libres - méthyle.
Nous les organisons d'abord pour différents carbones dans la chaîne principale. Nous appelons l'isomère résultant -2,3 diméthylpentane.
Maintenant, laissez un radical au même endroit et transférez le second au prochain atome de carbone de la chaîne principale. Cette substance est appelée 2,4 diméthylpentane.
Maintenant, nous plaçons des radicaux hydrocarbonés sur un atome de carbone. Premièrement, le second, nous obtenons 2,2 diméthylpentane. Puis le troisième, recevant 3,3 diméthylpentane.
Maintenant, nous laissons quatre atomes dans la chaîne principalecarbone, les trois restants sont utilisés comme radicaux méthyle. Nous les organisons comme suit: deux au deuxième atome C, un au troisième carbone. Nous appelons l'isomère résultant: 2,2, 3 triméthylbutane.
En utilisant l'heptane comme exemple, nous avons examiné comment formuler correctement les isomères pour les hydrocarbures saturés. La photo montre des exemples d'isomères structuraux du butène6 et de ses dérivés chlorés.
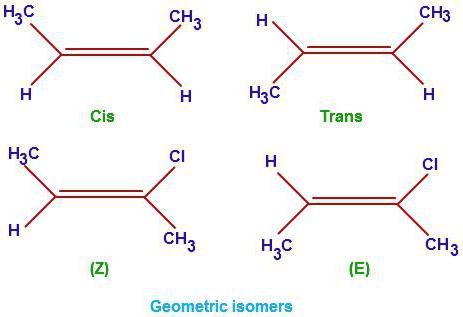
Cette classe de substances organiques a un point communformule CnH2n. Outre les liaisons C - C saturées, cette classe possède également une double liaison. Il détermine les propriétés de base de cette série. Parlons de la façon de laisser les isomères des alcènes. Essayons d'identifier leurs différences avec les hydrocarbures saturés. En plus de l'isomérie de la chaîne principale (formules structurales), les représentants de cette classe d'hydrocarbures organiques sont également caractérisés par trois autres variétés d'isomères: géométrique (cis et transform), positions de liaisons multiples et isomérie interclasse (avec cycloalcanes).

Essayons de comprendre comment composer les isomères de c6h12, étant donné qu'une substance avec cette formule peut appartenir à deux classes de substances organiques à la fois: les alcènes, les cycloalcanes.
Tout d'abord, réfléchissons à la façon de fabriquer des isomèresalcènes s'il y a une double liaison dans la molécule. Nous mettons une chaîne de carbone droite, mettons une liaison multiple après le premier atome de carbone. Essayons non seulement de compiler les isomères de c6h12, mais aussi de nommer les substances. Cette substance est l'hexène - 1. Le nombre indique la position dans la molécule de double liaison. En se déplaçant le long de la chaîne carbonée, nous obtenons de l'hexène -2, ainsi que de l'hexène - 3
Nous allons maintenant discuter de la façon de fabriquer des isomères pour cette formule en modifiant le nombre d'atomes dans la chaîne principale.
Tout d'abord, nous raccourcissons le squelette en carbone d'unatome de carbone, il sera considéré comme un radical méthyle. Nous quittons la double liaison après le premier atome C. L'isomère résultant selon la nomenclature systématique aura le nom suivant: 2 méthylpentène - 1. Maintenant, nous déplaçons le radical hydrocarboné le long de la chaîne principale, laissant la position de la double liaison inchangée. Cet hydrocarbure ramifié insaturé est appelé 3 méthylpentène -1.
Un autre isomère est possible sans changer la chaîne principale et la position de la double liaison: 4 méthylpentène -1.
Pour la composition C6H12, vous pouvez essayer de déplacerdouble liaison de la première à la deuxième position, sans transformer la chaîne principale elle-même. Dans ce cas, le radical se déplacera le long du squelette carboné, à partir du deuxième atome C. Cet isomère est appelé 2 méthylpentène-2. De plus, le radical CH3 du troisième atome de carbone peut être placé pour obtenir 3 méthylpentène-2
Si vous placez le radical au quatrième carbone de l'atome dans cette chaîne, une autre nouvelle substance se forme, un hydrocarbure insaturé avec un squelette de carbone sinueux - 4 méthylpentène-2.
Avec une nouvelle réduction du nombre C dans la chaîne principale, un isomère supplémentaire peut être obtenu.
On quitte la double liaison après le premier atome de carbone, et on met les deux radicaux sur le troisième atome C de la chaîne principale, on obtient 3,3 diméthylutène-1.
Maintenant, mettez les radicaux au carbone voisinsans changer la position de la double liaison, on obtient le 2,3 diméthylbutène-1. Essayons, sans changer la taille de la chaîne principale, de déplacer la double liaison vers la deuxième position. Dans ce cas, nous ne pouvons délivrer des radicaux qu'à 2 et 3 atomes de carbone, ayant obtenu le 2,3 diméthylbutène-2.
Il n'y a pas d'autres isomères structuraux pour cet alcène; toute tentative de les inventer entraînera une violation de la théorie de la structure des substances organiques par A. M. Butlerov.

Nous découvrons maintenant comment composer des isomères et des homologues du point de vue de l'isomérie spatiale. Il est important de comprendre que les transformations cis et alcène ne sont possibles que pour les positions de double liaison 2 et 3.
Lorsque les radicaux hydrocarbonés sont dans le même plan, le cis se forme - mesurant l'hexène -2, et lorsque les radicaux sont situés dans des plans différents, la forme trans de l'hexène est 2.
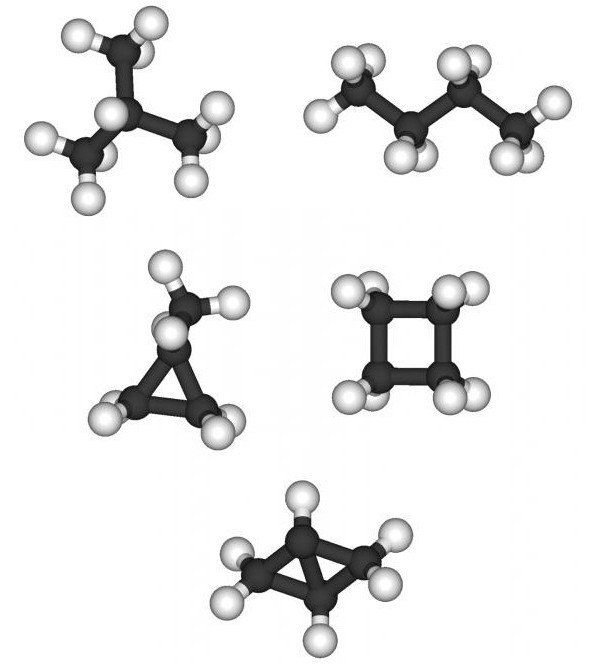
Discuter de la façon de fabriquer des isomères ethomologues, il ne faut pas oublier une option telle que l'isomérie interclasse. Pour les hydrocarbures insaturés d'un certain nombre d'éthylène ayant la formule générale CnH2n, les cycloalcanes sont de tels isomères. Une caractéristique de cette classe d'hydrocarbures est la présence d'une structure cyclique (fermée) avec des liaisons simples saturées entre les atomes de carbone. Des formules de cyclohexane, méthylcyclopentane, diméthylcyclobutane, triméthylcyclopropane peuvent être formulées.
La chimie organique est multiforme, mystérieuse.La quantité de substances organiques dépasse des centaines de fois le nombre de composés inorganiques. Ce fait s'explique facilement par l'existence d'un phénomène aussi unique que l'isomérisme. Si les substances homogènes en termes de propriétés et de structure se trouvent dans la même série homologique, alors lorsque la position des atomes de carbone dans la chaîne change, de nouveaux composés appelés isomères apparaissent. Ce n'est qu'après l'apparition de la théorie de la structure chimique des substances organiques qu'il a été possible de classer tous les hydrocarbures, de comprendre les spécificités de chaque classe. L'une des dispositions de cette théorie est directement liée au phénomène d'isomérie. Le grand chimiste russe a pu comprendre, expliquer, prouver que les propriétés chimiques d'une substance, son activité réactionnelle et son application pratique dépendent précisément de l'emplacement des atomes de carbone. Si l'on compare le nombre d'isomères formés par des alcanes saturés et des alcènes insaturés, les alcènes sont certainement en tête. Cela s'explique par le fait que dans leurs molécules il y a une double liaison. À savoir, il permet à cette classe de substances organiques de former non seulement des alcènes de divers types et structures, mais aussi de parler de l'isomérie de la classe avec les cycloalcanes.


























