
U ovom članku razmotrit ćemo proizvodnju sumporovodika. Razmotrimo detaljnije fizikalna i kemijska svojstva ove tvari.

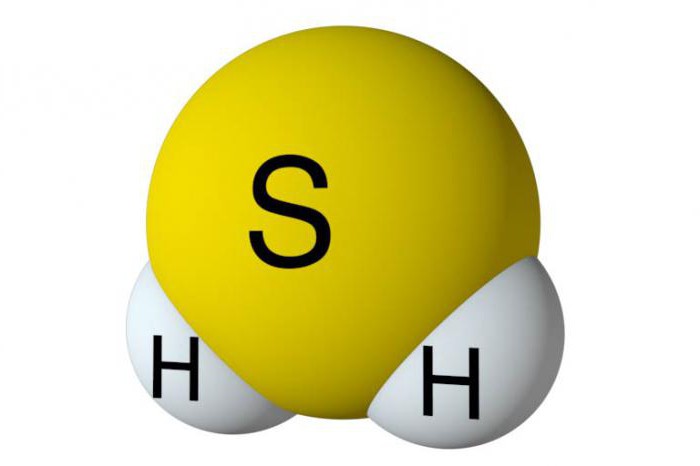
Da bi se analiziralo glavnodobivanje sumporovodika, potrebno je saznati značajke njegove strukture. Sastav ove tvari sadrži jedan atom sumpora i dva vodika. Oni su nemetali, dakle, kovalentne polarne veze nastaju između elemenata. U vodikovom sulfidu je kutna struktura. Između sumpora i vodika nastaje kut od 92 stupnja, što je nešto manje nego u vodi.
Miris sumporovodika, sličan trulim jajima,svima poznato. Pod normalnim uvjetima, ova tvar je u plinovitom stanju. Nema boju, slabo topiva u vodi, otrovna. U prosjeku, na 20 stupnjeva Celzijusa, 2,4 volumena sumporovodika će se otopiti u vodi. U vodi sumporovodika otkrivene su neznatne kiselinske osobine, a disocijacija tvari odvija se u koracima. Otrovni sumporovodik opasan je čak iu malim dozama. Sadržaj u zraku oko 0,1 posto sumporovodika dovodi do paralize dišnog centra s gubitkom svijesti. Na primjer, legendarni prirodoslovac Plinije Stariji umro je u 79. stoljeću prije Krista upravo zbog sumporovodika, koji je nastao tijekom erupcije Vesuviusa.
Uzrok trovanja hidrogen sulfida u kemijskoj interakciji s hemoglobinom. Željezo sadržano u ovom proteinu formira sulfid s vodikovim sulfidom.
Maksimalna dopuštena koncentracija u zrakusumpor vodikovog sulfida smatra se 0,01 mg / l. Kao protuotrov se koristi inhalacija čistog kisika ili zraka, u čijem se dijelu nalazi neznatna količina klora.
Rad sa sumporovodikom uključuje poštivanje određenih sigurnosnih pravila. Svi pokusi u vezi s ovom plinovitom tvari provode se u zatvorenim instrumentima i nape.

Što je primanje sumporovodika u laboratoriju? Najčešća opcija je interakcija vodika sa sumporom. Ova kemijska reakcija odnosi se na spoj koji se drži u digestoru.
Pored toga, moguća je proizvodnja sumporovodika saizmjena između čvrstog željeznog sulfida (2) i otopine sumporne ili klorovodične kiseline. Da biste dobili ovaj rezultat, u epruvetu je dovoljno uzeti nekoliko komada sulfida, koji ne prelaze veličinu graška. Zatim se otopina kiseline dodaje u epruvetu (do polovine volumena), zatvorenu plinskom cijevi. Uređaj je postavljen ispod haube, cijev se zagrijava. Kemijska interakcija je praćena ispuštanjem mjehurića plina. Ova proizvodnja sumporovodika omogućuje vam stvaranje količine tvari dovoljne za razmatranje njegovih kemijskih svojstava.
Koji su još načini?U laboratoriju se sumporovodik može dobiti reakcijom metalnog željeza (ispod haube) s kristalnim sumporom, nakon čega slijedi interakcija sulfida sa sumpornom kiselinom.

Vodikov sulfid djeluje u atmosferi kisika,gori plavkastom bojom. U slučaju potpunog izgaranja, produkti reakcije su sumpor-oksid (4) i voda. S obzirom da je plin iz peći kiselinski oksid, u otopini formira slabu sumpornu kiselinu, koja plavi lakmusov papir pretvara u crveni.
U slučaju nedovoljnog sumporovodika nastaje kristalni sumpor. Ovaj se postupak smatra industrijskom metodom dobivanja čistog sumpora iz vodikovog sulfida.
Ova je kemikalija identificirala iizvrsna sposobnost oporavka. Pojavljuju se, na primjer, u interakciji sa solima, halogenima. Da bi se izvela slična reakcija u laboratorijskim uvjetima, u epruvete s klorom i bromom ulijeva se otopina hidrogen sulfida, primjećuje se promjena boje. Kao produkt reakcije uočeno je stvaranje kristalnog sumpora.
Tijekom kemijske reakcije vodikovog sulfida s vodom dolazi do stvaranja hidroksonijevog kationa H30 +.
Vodikov sulfid sposoban je stvoriti dvije vrste spojeva: sulfide (srednje soli) i hidrosulfide (kisele soli).
Sulfidi alkalnih i zemnoalkalnih metalasu bezbojni spojevi. U teškim metalima (bakar, nikal, olovo) imaju crnu boju. Mangan-sulfid je ružičaste boje. Mnoge soli nisu topive u vodi.
Kvalitativnom reakcijom na sulfide smatra se interakcija s otopinom bakrenog sulfata (2). Proizvod ove interakcije bit će taloženje crnog taloga bakrenog sulfida (2).
U prirodi se ta tvar nalazi u mineralimaizvori, vulkanski plinovi. Ovaj spoj proizvod je truleži životinja i biljnih organizama, odlikuje se karakterističnim mirisom sumporovodika. Prirodni sulfidi nalaze se u rijetkim metalima, a u metalurgiji se iz njih dobivaju odgovarajući elementi. Važno je zapamtiti da je vodikov sulfid snažna otrovna tvar.


























