
Izraz "ozonski omotač" koji je postao poznat 70-ih godinadvogodišnja prošlog stoljeća, odavno je postavljena na rubu. Istodobno, malo ljudi stvarno razumije što ovaj koncept znači i koliko je opasno uništavanje ozonskog omotača. Još veća misterija za mnoge je struktura molekule ozona, a zapravo je izravno povezana s problemima ozonskog omotača. Doznajmo više o ozonu, njegovoj strukturi i industrijskoj primjeni.
Ozon, ili, kako ga još nazivaju i aktivni kisik, je azurni plin oštrog metalnog mirisa.

Ova tvar može postojati u sva tri agregacijska stanja: plinovitom, krutom i tekućem.
Istodobno, u prirodi se ozon nalazi samo u obliku plina koji tvori takozvani ozonski sloj. Zbog svoje azurne boje nebo se čini plavim.
Ozon je dobio nadimak "aktivni kisik"zbog njegove sličnosti s kisikom. Dakle, glavni aktivni kemijski element u tim tvarima je kisik (O). Međutim, ako molekula kisika sadrži 2 svoja atoma, tada molekula ozona (formula - O3) sastoji se od 3 atoma ovog elementa.
Zbog ove strukture svojstva ozona slična su svojstvima kisika, ali izraženija. Konkretno, poput O2, O3 je najjače oksidirajuće sredstvo.
Najvažnija razlika između ovih "povezanih"tvari koje su vitalne za pamćenje su sljedeće: ozon se ne može disati, otrovan je i ako se udiše može oštetiti pluća ili čak ubiti osobu. Štoviše, O3 savršeno za pročišćavanje zraka od otrovnih nečistoća. Usput, upravo je zbog toga tako lako disati nakon kiše: ozon oksidira štetne tvari sadržane u zraku i pročišćava se.
Model molekule ozona (sastoji se od 3 atomakisik) malo podsjeća na sliku kuta, a njegova je veličina 117 °. Ova molekula nema nesparenih elektrona, stoga je dijamagnetska. Uz to, ima polaritet, iako se sastoji od atoma istog elementa.
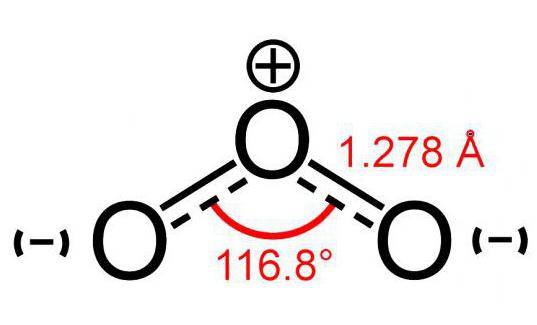
Dva atoma ove molekule čvrsto su povezanasami. Ali veza s trećim manje je pouzdana. Iz tog je razloga molekula ozona (fotografija modela vidi se u nastavku) vrlo je krhka i raspada se nedugo nakon stvaranja. U pravilu, za bilo koju reakciju raspada O3 oslobađa se kisik.
Zbog nestabilnosti ozona nemoguće ga je nabaviti i skladištiti, kao ni transportirati poput ostalih tvari. Iz tog je razloga njegova proizvodnja skuplja od ostalih tvari.
Istodobno, visoka aktivnost O3 omogućuje ovoj tvari da bude najjače oksidirajuće sredstvo, snažnije od kisika i sigurnije od klora.
Ako je molekula ozona uništena i O2, ovu reakciju uvijek prati oslobađanje energije. Istodobno, da bi se dogodio obrnuti proces (stvaranje O3 od otprilike2), potrebno ga je barem potrošiti.
U plinovitom stanju, molekula ozonaraspada se na 70 ° C. Ako se poveća na 100 ili više stupnjeva, reakcija će se znatno ubrzati. Prisutnost nečistoća također ubrzava razdoblje raspadanja molekula ozona.
Bez obzira u koje se od tri države nalazi ozon, on zadržava svoju plavu boju. Što je tvar tvrđa, to je nijansa bogatija i tamnija.

Svaka molekula ozona teži 48 g / mol. Teži je od zraka, što pomaže razdvajanju tih tvari među sobom.
oh3 sposoban oksidirati gotovo sve metale i nemetale (osim zlata, iridija i platine).
Također, ova tvar može sudjelovati u reakciji izgaranja, ali za to je potrebna viša temperatura nego za O2.
Ozon se može otopiti u H2O i freoni. U tekućem stanju može se miješati s tekućim kisikom, dušikom, metanom, argonom, ugljikovim tetrakloridom i ugljičnim dioksidom.
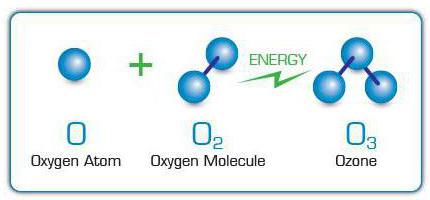
Molekule O3 nastaju spajanjem slobodnih atoma kisika na molekule kisika. Oni se pak pojavljuju zbog cijepanja drugih molekula O2 zbog utjecaja električnih pražnjenja na njih,ultraljubičaste zrake, brzi elektroni i druge čestice visoke energije. Iz tog razloga, specifičan miris ozona može se osjetiti u blizini iskrećih električnih uređaja ili svjetiljki koje emitiraju ultraljubičastu svjetlost.

U industrijskim razmjerima O3 emitira se pomoću električnih generatora ozona ili ozonizatora. U tim uređajima električna struja visokog napona prolazi kroz struju plina u kojoj O2, čiji atomi služe kao "građevinski materijal" za ozon.
Ponekad se u ove uređaje pumpa čisti kisik ili obični zrak. Kvaliteta nastalog ozona ovisi o čistoći početnog proizvoda. Dakle, medicinski O3, namijenjen za liječenje rana, ekstrahira se samo iz kemijski čistog O2.
Nakon što smo shvatili kako molekula ozona izgleda i kako nastaje, vrijedi se upoznati s poviješću ove tvari.
Prvi su ga sintetizirali Nizozemciistraživač Martin Van Marum u drugoj polovici 18. stoljeća. Znanstvenik je primijetio da je nakon prolaska električnih iskri kroz posudu sa zrakom plin u njemu promijenio svojstva. Istodobno, Van Marum nije razumio da je izolirao molekule nove tvari.
I ovdje je njegov njemački kolega po imenu Scheinbein, koji pokušava razgraditi H2O na N i O2, skrenuo je pozornost na ispuštanje novog plina oštrog mirisa. Nakon što je proveo puno istraživanja, znanstvenik je opisao supstancu koju je otkrio i dao joj ime "ozon" u čast grčke riječi za "miris".
Sposobnost ubijanja gljivica i bakterija, kao i smanjenje toksičnosti štetnih spojeva, koje je posjedovala otvorena tvar, zanimala je mnoge znanstvenike. 17 godina nakon službenog otvorenja O3 Werner von Siemens dizajnirao je prvuuređaj koji vam omogućuje sintezu ozona u bilo kojoj količini. I 39 godina kasnije, briljantni Nikola Tesla izumio je i patentirao prvi generator ozona na svijetu.
Bio je to uređaj, već dvije godine kasnije, prvi putkoristi se u Francuskoj u postrojenjima za pročišćavanje pitke vode. S početkom XX. Stoljeća. Europa počinje prelaziti na ozonizaciju pitke vode radi njenog pročišćavanja.
Rusko se carstvo prvi put koristilo ovom tehnikom 1911. godine, a 5 godina kasnije u zemlji je opremljeno gotovo 4 tuceta postrojenja za pročišćavanje pitke vode pomoću ozona.
Danas ozoniranje vode postupno zamjenjuje kloriranje. Tako se 95% sve pitke vode u Europi pročišćava s O3... Ova je tehnika također vrlo popularna u SAD-u. U ZND-u se još uvijek proučava, jer je, iako je ovaj postupak sigurniji i prikladniji, skuplji od kloriranja.
Osim pročišćavanja vode, Oh3 ima niz drugih područja primjene.
Na udaljenosti od 15-35 km iznad Zemljine površine nalazi se ozonski omotač, ili, kako se još naziva, ozonosfera. Na ovom mjestu koncentrirani O3 služi kao vrsta filtra za štetno sunčevo zračenje.
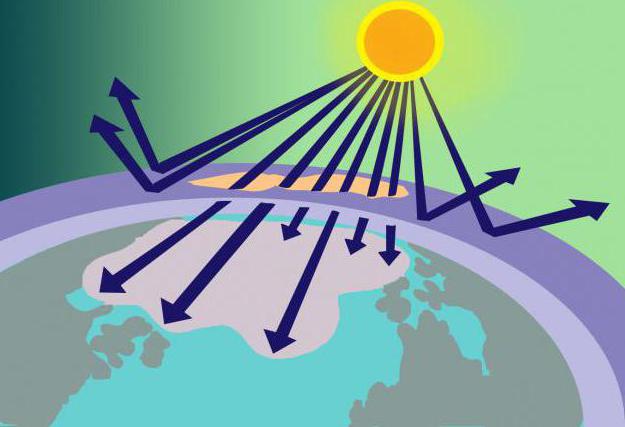
Odakle dolazi ova količina tvari akojesu li njegove molekule nestabilne? Odgovor na ovo pitanje nije težak ako se prisjetimo modela molekule ozona i načina njegovog stvaranja. Dakle, kisik, koji se sastoji od 2 molekule kisika, ulazeći u stratosferu, tamo se zagrijava sunčevim zrakama. Pokazalo se da je ta energija dovoljna za razdvajanje O2 u atome od kojih nastaje O3... Istodobno, ozonski omotač ne samo da koristi dio sunčeve energije, već je i filtrira, upija opasnu ultraljubičastu svjetlost.
Gore je rečeno da se ozon otapa freonima.Te plinovite tvari (koje se koriste u proizvodnji dezodoransa, aparata za gašenje požara i hladnjaka), nakon ispuštanja u atmosferu, utječu na ozon i pridonose njegovom razgradnji. Kao rezultat toga, u ozonosferi se pojavljuju rupe kroz koje na planet ulaze nefiltrirane sunčeve zrake koje destruktivno utječu na žive organizme.
Razmotrivši značajke i strukturu molekula ozona, može se doći do zaključka da je ta tvar, iako opasna, vrlo korisna za čovječanstvo ako se pravilno koristi.


























