
A kémiai kötés két vagy több atom (molekula) kötése egy szerves vagy szervetlen vegyületben. A rendszerben az összenergia csökkenésének feltételeként képződik.
A periódusos rendszer összes elemének különbözete vankommunikációs képesség. A legstabilabb és ennek eredményeként kémiailag inaktív atomok nemes (inert) gázok, mivel két vagy nyolc elektronot tartalmaznak a külső elektronhéjon. Kis számú kötvényt képeznek. Például a neon, a hélium és az argon semmilyen elemmel nem képez kémiai kötést, míg a xenon, a kripton és a radon reagálnak fluortartalmú és vízmolekulákkal.
Más elemek atomjai külső szintjei nem teljesek és 1-7 elektronot tartalmaznak, ezért a héj stabilitásának fokozása érdekében kémiai kötéseket képeznek.
Különböző típusú kommunikáció létezik:
Az ilyen típusú kötés a benzin atomjai között alakul kimolekula a valencia elektronpár szocializációjának vagy átfedésének eredményeként. Ennek megfelelően vannak kovalens kötések képződésének (a) és donor-elfogadó (b) mechanizmusai. Különálló eset egy nappali kapcsolat, amelyet az alábbiakban tárgyalunk.

A külső szintű atomok páratlanokelektronok. Az interakció során a külső héjak átfedésben vannak. A külső szinteken lévő egyes elektronok párhuzamos spinjei párosulnak, és mindkét atomra közös elektronpárt képeznek. Ez az elektronpár valójában egy kovalens kötés, amelyet például a hidrogénmolekulában a cseremechanizmus hoz létre.
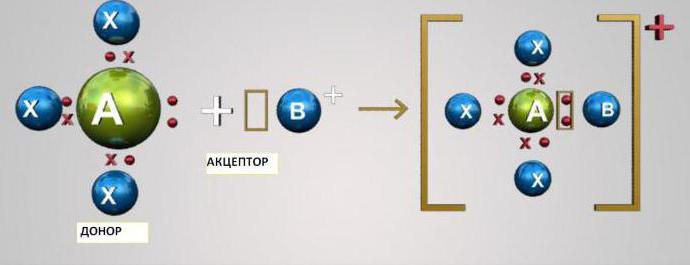
Ez a mechanizmus a szocializáció.a külső szinten elhelyezkedő két elektron két atomja. Ebben az esetben az egyik atom donorként működik (két elektronot szolgáltat), a másik pedig akceptorként (üres elektronok körüli pályája van). Az s- és p-elemek atomjai lehetnek akceptorok vagy elektron donorok. A d-elemek atomjai lehetnek donorok és elfogadók is.
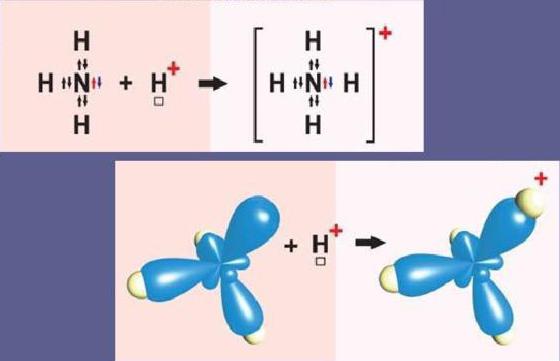
A donor-elfogadó mechanizmus megértéséhez két legegyszerűbb példát tekintünk - a hidroxónium-H-kationok képződését3Oh+ és ammónium-NH4+.
Vázlatosan az ammónium-részecske képződésének reakciója a következő:
HH3+ X+= NH4+
Az N atomban az elektronok a következő sorrendben oszlanak meg: 1s2 2s2 2n3.
A H kation elektronikus szerkezete: 1s0.
A nitrogénatom külső szinten két s- és atomot tartalmazhárom p-elektron. Három p-elektron vesz részt a kovalens csere-típusú nitrogén-hidrogén N-H kötések kialakításában. Ennek eredményeként az ammónia molekula NH3 kovalens típusú kötéssel. Mivel az N nitrogénatom külső szintjén is van egy elektronpár, az NH molekula3 köthet hidrogénkationt is. Az ammónia molekula donor, és a hidrogénkation H+ - egy akceptor, amely donor elektronokat vesz át a nitrogéntől a saját szabad s-orbitaljáig.
Az oxigénatom elektronjai a következő sorrendben oszlanak meg: 1s2 2s2 2n4.
Az oxigénatom külső szintjén két s ésnégy p-elektron. Ennek alapján két szabad p-elektron és két s-elektron két H atomból vesz részt a H-O kötések kialakításában, vagyis 2 rendelkezésre álló kötés a H molekulaban2O - kovalens, amelyet a cseremechanizmus hoz létre.
A hidrogénkation elektronikus szerkezete: 1s0.
Mivel az oxigénatom külső szintje vanMég mindig van két elektron (s-típusú), ez képezhet egy harmadik kovalens kötést a donor-elfogadó mechanizmus által. Az akceptor lehet egy szabad pályával rendelkező atom, ebben a példában H részecske lehet+. A H kation szabad s-pályája+ foglalja el az oxigénatom két elektronját.

Donor-elfogadó kovalens kötési mechanizmusnem csak az atom-atom vagy a molekula-atom kölcsönhatásokban lehetséges, hanem a molekulák közötti reakciókban is. A kinetikusan független molekulák donor-akceptor kölcsönhatásának egyetlen feltétele az entrópia csökkenése, vagyis a kémiai szerkezet sorrendjének növekedése.
Tekintsük az első példát - az aprotsav (Lewis sav) NH képződése3BF3. Ez a szervetlen komplex ammónia molekula és bór-fluorid hozzáadása közben képződik.
HH3+ BF3= NH3BF3
A bór-atom elektronjai a következő sorrendben oszlanak meg: 1s2 2s2 2n1.
Amikor a B-atom gerjesztett, az egyik s-típusú elektron átkerül a p-alsó szintbe (1s2 2s1 2n2). Így a gerjesztett bóratom külső szintjén két s és két p elektron van.
A BF molekulában3 три ковалентные связи бор-фтор B-F образованы csere típusa (a bór- és fluoratomok mindegyikében egy elektron van). Három kovalens kötés kialakulása után a bór-atomnál a szabad p-alsó réteg megmarad a külső elektronhéjon, amelynek következtében a bór-fluorid-molekula elektron-elfogadóként működhet.
A nitrogénatomban az elektronok a következő sorrendben oszlanak meg: 1s2 2s2 2n3.
Az N és H atomból három elektron vesz résztnitrogén-hidrogén kötések kialakulása. Ezután a nitrogénnek két további s-típusú elektronja van, amelyek biztosítják a kötések kialakulását a donor-elfogadó mechanizmus által.
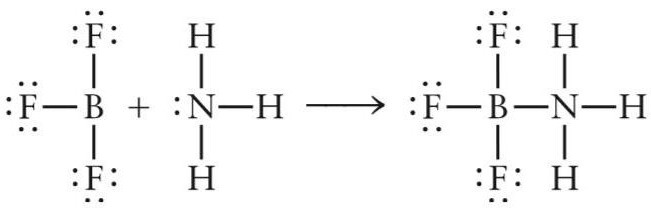
Bór-trifluorid és ammónia reakciójában NH molekula3 játszik egy elektron donor és a BF molekula szerepét3 - elfogadó. Egy pár nitrogén elektron elfoglalja a bór-fluorid és az NH kémiai vegyület szabad pályáját3BF3.
A donor-akceptor kötésképző mechanizmus másik példája a berillium-fluorid-polimer előállítása.
Séma szerint a reakció a következő:
BeF2+ BeF2+ ... + BeF2-> (BeF2)n
A Be atom atomjában az elektronok így vannak elrendezve - 1s2 2s2és az F - 1s atomban2 2s2 2n5.
A berillium-fluorid-molekulában két berillium-fluor-kötés kovalens cserélő típusú (két fluoratomból álló két p-elektron és a berillium-atom két alsó szintű elektronja vesz részt).
Egy pár berillium (Be) és fluor (F) atom közötttovábbi két kovalens kötést képez a donor-elfogadó mechanizmus. A berillium-fluorid-polimerben a fluoratom elektron donor, a berillium-atom akkreditátora, amelyben üres pálya van.
Mikor alakul ki a kommunikációa szerves természetű molekulák között a vizsgált mechanizmus összetettebb vegyületeket képez - komplexeket képez. Bármely kovalens kötésű szerves vegyület tartalmaz elfoglalt (nem-kötő és kötő) és üres orbitálokat (lazító és nem kötő). A donor-akceptor komplexképződés lehetőségét a komplex stabilitás mértéke határozza meg, amely a kötés erősségétől függ.
Vegyünk egy példát - az interakció reakciójátA metil-amin molekulák sósavval metil-ammónium-kloridot képeznek. Egy metil-aminmolekulában az összes cseremechanizmus által létrehozott kovalens kötés - két H-N kötés és egy N-CH kötés3. Hidrogénnel és metil-rel való kötés utánA nitrogénatom csoportként s-típusú elektronokat tartalmaz. Donorként ezt az elektronpárt bocsátja rendelkezésre egy hidrogénatom (akceptor) számára, amelynek szabad pályája van.

Nem minden esetben az adományozó-elfogadóAz interakció az elektronikus pár szocializációja és a kommunikáció kialakulása. Néhány szerves vegyület kombinálható egymással úgy, hogy a megtöltött donor orbitalát átfedjük az üres akceptor pályával. A töltés átadódik - az elektronok az akceptor és a donor között delokálódnak, nagyon közel helyezkednek el egymással. Készülnek töltési átvitellel (CTC) komplexek.
Ez az interakció a pi rendszerekre jellemző,amelyek körüli pályái könnyen átfedik egymást, és az elektronok könnyen polarizálódnak. A donorok szerepe lehet metallocének, telítetlen aminosavak és TDAE (tetrakis (dimetilamino) etilén). Az elfogadók gyakran fullerének, a kinodimetánok akceptorszubsztituensekkel rendelkeznek.
A töltés részleges vagy teljes lehet. A teljes töltés a molekula fotoexcitációjakor következik be. Ebben az esetben egy komplex alakul ki, amely spektrálisan megfigyelhető.
Függetlenül attól, hogy a díjátutalás hiánytalan-e, példáula komplexek instabilok. Az ilyen állapotok erősségének és élettartamának növelése érdekében hídcsoportot vezetnek be. Ennek eredményeként a donor-elfogadó rendszereket sikeresen alkalmazzák a napenergia-átalakító eszközökben.
Egyes szerves molekulákban a kötésegy donor-elfogadó mechanizmus alakul ki a molekula belsejében a donor és az elfogadó csoport között. Ezt a típusú interakciót transzannuláris hatásnak nevezzük, amely jellemző például atornákra (N-> B-, N-> Si-kötésű organoelemek).
Amellett, hogy a csere és a donor-elfogadó otta harmadik mechanizmus native (más nevek semipoláris, semipoláris vagy koordinációs). Egy donor atom elektronpárt ad egy semleges atom szabad pályájához, amelynek két elektronra van szüksége a külső szint teljesítéséhez. Az elektron sűrűségének sajátos átmenete történik az akceptorról a donorra. Ebben az esetben a donor pozitív töltéssel (kation), és az akceptor negatív töltéssel (anion) válik.
Maga a kémiai kötés az alábbiak miatt alakul kikötési héj (az egyik atom két párosított elektronjának átfedése az atom külső szabad szabad pályájával) és a kation és az anion között kialakuló elektrosztatikus vonzerő. Így a kovalens és az ionos típusok egy félpólusú kötésben vannak kombinálva. A félpólusú kötés a d-elemekre jellemző, amelyek különböző vegyületekben mind az elfogadó, mind a donor szerepet játszhatnak. A legtöbb esetben összetett és szerves anyagokban található meg.
A legegyszerűbb példa a klór-molekula.Az egyik Cl-atom elektronpárt ad ki egy másik klóratomnak, amelynek szabad d-orbitálja van. Ebben az esetben az egyik Cl-atom pozitív töltésű, a másik negatív töltésű, és közöttük elektrosztatikus vonzás merül fel. A nagy hosszúság miatt a natív kötés kisebb erősségű, mint a kovalens csere- és donor-elfogadó típusok, viszont jelenléte növeli a klórmolekula erősségét. Ezért van a Cl molekula2 tartósabb, mint az F2 (a fluoratomnak nincsenek d-pályái, a fluor-fluor kötés csak kovalens csere).
Szén-monoxid-molekula CO (szén-monoxid)három C-O kötéssel képezve. Mivel az oxigén- és a szénatomok külső szintjén két egyetlen elektron van, két kovalens cserélő kötés jön létre közöttük. Ezután egy üres pálya marad a szénatomon, és két elektron elektron pár az O atom külső oldalán. Ezért a szén-monoxid (II) molekulájában van egy harmadik kötés - egy félpólusú kötés, amely két valenciapárosított oxigén-elektron és egy szabad szén-pálya következtében jön létre.
Vegyünk egy összetettebb példát - az ilyen típusú kötés kialakulása a dimetil-éter (Н3С-О-СН) kölcsönhatásának példáján.3) alumínium-klorid-kloriddal3... A dimetil-éterben lévő oxigénatomot kettő kapcsolja összekovalens kötések metilcsoportokkal. Ezután még két elektronja van a p-alsó szinten, amelyet az akceptor atomnak (alumínium) ad és pozitív kationvá válik. Ebben az esetben az akceptor atom negatív töltést kap (aniontá alakul). A kation és az anion elektrosztatikusan kölcsönhatásba lépnek egymással.
Donor-elfogadó kötésképző mechanizmusAz emberi életben fontos, és széles körben elterjedt mind szerves, mind szervetlen vegyületekben, amit a fentiekben bemutatott példák is alátámasztanak. Az ammónium-alkoholt, amely ammónium-kationt tartalmaz, sikeresen használják a mindennapi életben, az orvostudományban és a műtrágyák ipari előállításában. A hidrónium-ion nagy szerepet játszik a savak vízben való oldódásában. A szén-monoxidot az iparban használják (például műtrágyák, lézerrendszerek előállításában), és nagy jelentőséggel bír az emberi test élettani rendszereiben.


























