
70年代に有名になった「オゾン層」という言葉ビエンニウム前世紀は、長い間限界に達してきました。同時に、この概念が何を意味し、オゾン層の破壊がどれほど危険であるかを本当に理解している人はほとんどいません。多くの人にとってさらに大きな謎はオゾン分子の構造であり、実際それはオゾン層の問題に直接関係しています。オゾン、その構造、および産業用途について詳しく見ていきましょう。
オゾン、または別名活性酸素は、刺激的な金属臭のある紺碧のガスです。

この物質は、気体、固体、液体の3つの凝集状態すべてで存在する可能性があります。
同時に、自然界では、オゾンはガスの形でのみ見られ、いわゆるオゾン層を形成します。空が青く見えるのは紺碧の色のせいです。
オゾンは「活性酸素」というあだ名がついた酸素と類似しているためです。したがって、これらの物質の主な活性化学元素は酸素(O)です。ただし、酸素分子に2つの原子が含まれている場合、オゾン分子(式-O3)は、この元素の3つの原子で構成されます。
この構造により、オゾンの特性は酸素の特性と似ていますが、より顕著です。特に、Oのように2、 約3 最強の酸化剤です。
これらの「関連する」間の最も重要な違い誰もが覚えておくべき重要な物質は次のとおりです。オゾンは呼吸できず、毒性があり、吸入すると肺に損傷を与えたり、人を殺したりする可能性があります。また、O3 有毒な不純物からの空気浄化に最適です。ちなみに、雨上がりの呼吸がしやすいのはまさにこのためです。オゾンは空気中の有害物質を酸化して浄化します。
オゾン分子モデル(3つの原子からなる)酸素)は角度のイメージに少し似ており、そのサイズは117°です。この分子には不対電子がないため、反磁性です。また、同じ元素の原子で構成されていますが、極性があります。
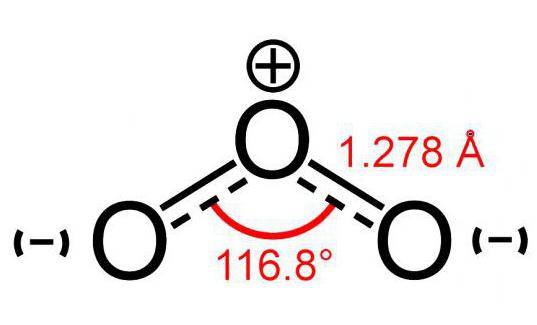
この分子の2つの原子はしっかりと結合していますあなた自身。しかし、3番目との接続は信頼性が低くなります。このため、オゾン分子(モデルの写真は下に表示されています)は非常に壊れやすく、形成後すぐに分解します。原則として、Oの崩壊の反応について3 酸素が放出されます。
オゾンは不安定であるため、他の物質と同じように調達・保管したり、輸送したりすることはできません。このため、その製造は他の物質よりも高価です。
同時に、Oの高い活性3 この物質が最も強力な酸化剤であり、酸素よりも強力で、塩素よりも安全であることを可能にします。
オゾン分子が破壊されてO2、この反応は常にエネルギーの放出を伴います。同時に、逆のプロセスが発生するために(Oの形成3 約から2)、少なくともそれを使う必要があります。
気体状態では、オゾン分子70°Cで分解します。 100度以上に上げると反応が大幅に加速します。不純物の存在はまた、オゾン分子の崩壊期間を加速します。
オゾンがどのような状態にあっても、オゾンは青色を保ちます。物質が硬いほど、この色合いは濃く濃くなります。

各オゾン分子の重量は48g / molです。それは空気より重いので、これらの物質をそれらの間で分離するのに役立ちます。
ああ3 ほとんどすべての金属と非金属(金、イリジウム、プラチナを除く)を酸化することができます。
また、この物質は燃焼反応に関与する可能性がありますが、これにはOよりも高い温度が必要です2.
オゾンはHに溶解することができます2とフレオンについて。液体状態では、液体酸素、窒素、メタン、アルゴン、四塩化炭素、二酸化炭素と混合する可能性があります。
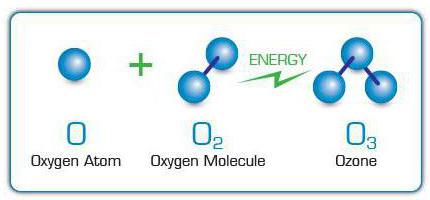
分子O3 遊離酸素原子を酸素分子に結合させることによって形成されます。それらは、他のO分子の開裂のために現れます2 放電の影響により、紫外線、高速電子、その他の高エネルギー粒子。このため、火花を散らす電化製品や紫外線を発するランプの近くでオゾン特有の臭いを感じることがあります。

産業規模でO3 電気オゾン発生器またはオゾン発生器を使用して放出されます。これらのデバイスでは、高電圧電流がガス流を通過します。2、その原子はオゾンの「建築材料」として機能します。
純粋な酸素または通常の空気がこれらのデバイスに送り込まれることがあります。得られるオゾンの品質は、最初の製品の純度に依存します。だから、医療O3傷の治療を目的とした、化学的に純粋なOからのみ抽出されます2.
オゾン分子がどのように見えるか、そしてそれがどのように形成されるかを理解したので、この物質の歴史を知ることは価値があります。
それは最初にオランダ人によって合成されました18世紀後半の研究者マルティンファンマルム。科学者は、電気火花を空気の入った容器に通した後、その中のガスがその特性を変えたことに気づきました。同時に、ファンマルムは、彼が新しい物質の分子を分離したことを理解していませんでした。
そして、これがシャインバインという名前の彼のドイツ人の同僚で、Hを分解しようとしています2NとOのO2、刺激臭のある新しいガスの放出に注目を集めました。多くの研究を行った後、科学者は彼が発見した物質を説明し、ギリシャ語の「匂い」に敬意を表して「オゾン」という名前を付けました。
真菌やバクテリアを殺す能力、そして開放物質が持っていた有害な化合物の毒性を減らす能力は、多くの科学者に興味を持っていました。 Oの公式オープンから17年3 ヴェルナーフォンシーメンスが最初に設計したオゾンを任意の量で合成できる装置。そして39年後、素晴らしいニコラ・テスラが世界初のオゾン発生器を発明し、特許を取得しました。
すでに2年後、初めてこの装置でしたフランスの飲料水処理プラントで使用されています。 20世紀の初めに。ヨーロッパは、浄化のために飲料水のオゾン処理に切り替え始めています。
ロシア帝国は1911年にこの技術を最初に使用し、5年後、オゾンを使用して飲料水を浄化するためのほぼ4ダースの設備が国内に装備されました。
今日、水のオゾン処理は徐々に塩素処理に取って代わりつつあります。したがって、ヨーロッパのすべての飲料水の95%はOで浄化されています3..。この手法は、米国でも非常に人気があります。 CISでは、この手順はより安全で便利ですが、塩素化よりも費用がかかるため、まだ調査中です。
浄水に加えて、ああ3 他にも多くの応用分野があります。
地球の表面から15〜35 kmの距離に、オゾン層、またはいわゆるオゾン圏があります。この場所に、濃縮されたO3 有害な日射の一種のフィルターとして機能します。
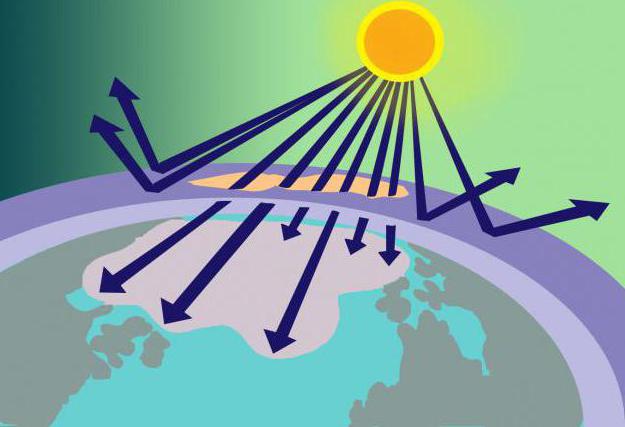
この量の物質はどこから来るのですかその分子は不安定ですか?オゾン分子のモデルとその形成方法を思い出せば、この質問への答えは難しくありません。したがって、成層圏に入る2つの酸素分子からなる酸素は、そこで太陽光線によって加熱されます。このエネルギーはOを分割するのに十分であることが判明しました2 Oが由来する原子に3..。同時に、オゾン層は太陽エネルギーの一部を使用するだけでなく、それをろ過し、危険な紫外線を吸収します。
オゾンはフレオンによって溶解されると上で言われました。これらのガス状物質(消臭剤、消火器、冷蔵庫の製造に使用される)は、大気中に放出されると、オゾンに影響を与え、その分解に寄与します。その結果、オゾン圏に穴が現れ、そこからろ過されていない太陽光線が惑星に入り、生物に破壊的な影響を与えます。
オゾン分子の特徴と構造を考えると、この物質は危険ではありますが、正しく使用すれば人類にとって非常に有用であるという結論に達することができます。
