
アンモニア - 窒化水素 - 窒素と水素の最も重要な化合物の一つ。それは色のないガスですが、刺激的な臭いがあります。化学組成は、アンモニア-NH3。圧力を上げるか、温度を下げるその物質は無色の液体へと変態する。ガス状アンモニアおよびその溶液は、産業および農業において広く使用されている。薬では、10%水酸化アンモニウムが使用されます - アンモニア。
窒化水素分子は、その基部に3個の水素原子が結合した窒素であるピラミッドである。 N-H結合は強く分極している。窒素は結合電子対を強く引きつける。したがって、負の電荷がN原子に蓄積し、正の電荷が水素に集中する。このプロセスのアイデアは、分子のモデル、アンモニアの電子式および構造式によって与えられる。

窒化水素は水に非常に溶けやすい。(20℃で700:1)。実際に遊離したプロトンの存在は、分子を互いに連結する多数の水素「架橋」を形成する。構造と化学結合の特長は、アンモニアが圧力の上昇または温度の低下(-33℃)で容易に液化するという事実にもつながります。

「アンモニア」という用語は、1801年、ロシアの化学者J.ザクロフロフの提案を受けたが、人類の実体は深い古代から馴染み深い。アンモニア塩の分解中にタンパク質や尿素などの多くの有機化合物を腐敗させると、匂いのあるガスが放出されます。化学者の歴史家は、その物質が古代エジプトの神アモンに敬意を表して名づけられたと信じています。北アフリカには、シワ(アンモン)のオアシスがあります。リビアの砂漠に囲まれ、古代都市の遺跡と寺院があり、その隣には塩化アンモニウムの堆積物があります。ヨーロッパのこの物質は、「アムーンの塩」と呼ばれていました。シワ・オアシスの住人たちは、寺院で塩を嗅ぐという伝説があります。
英語の物理学者および化学者R.実験では、ボイルは肥料を燃焼させ、塩酸に浸したスティック上に白煙の生成を観察し、得られたガスの流れに導入した。 1774年に、別の英国の化学者、D. Priestleyが塩化アンモニウムを消石灰で加熱し、ガス状の物質を放出した。プリーストリーは、その溶液が弱塩基の特性を示したので、化合物を「アルカリ性の空気」と呼んだ。アンモニアが塩酸と反応するボイルの経験について説明した。反応物質の分子が空気中で直接接触すると、白色固体の塩化アンモニウムが生じる。

アンモニアの化学式は、1875年にフランスのK. Bertholletが放電の作用で物質を構成成分に分解する実験を行った。今まで、Priestley、BoyleおよびBertholletの実験は、窒化水素および塩化アンモニウムの製造のための実験室で再現されてきた。窒素と水素から物質を合成する方法の特許を取得したA. Le Chatelierによって1901年に工業的方法が開発された。

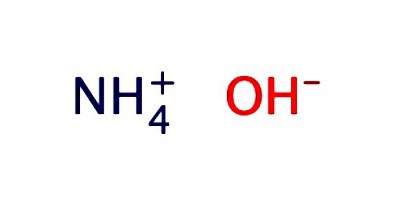
アンモニアの水溶液は、通常、水酸化物-NH4OH。それは弱アルカリの特性を示す:
アンモニアとアンモニアとの相互作用の反応における平衡元の物質に向かって水が移動します。予熱された窒化水素は酸素中でよく燃焼する。窒素は単体N2の二原子分子に酸化される。アンモニアはまた、酸化銅(II)との反応において還元性を示す。

窒化水素は塩生成に使用される。アンモニウムおよび硝酸 - 化学工業の最も重要な製品の1つです。アンモニアはソーダ製造の原料として使用される(硝酸塩法による)。工業用濃縮溶液中の窒化水素含有量は25%に達する。農業では、アンモニアの水溶液が使用される。液体肥料の式 - NH4OH。物質はトップドレッシングの形で直接使用されます。窒素で土壌を豊かにする他の方法 - アンモニウム塩の使用:硝酸塩、塩化物、リン酸塩。工業的条件および農業施設では、アンモニウム塩とアルカリを含むミネラル肥料を一緒に貯蔵することは推奨されない。包装の完全性が損なわれると、物質は互いに反応してアンモニアを生成し、それを室内空気中に放出することができる。毒性化合物は人の中枢神経系である呼吸器系に悪影響を与える。アンモニアと空気の混合物は爆発性である。
