
Parunāsim par to, kas ir OVR neorganiskajā un organiskajā sintēzē.
Redukcijas reakcijas nozīmē tādus procesus, kuru rezultātā divu vai vairāku ķīmisko elementu oksidēšanās pakāpe sarežģītās vai vienkāršās vielās mainīsies.

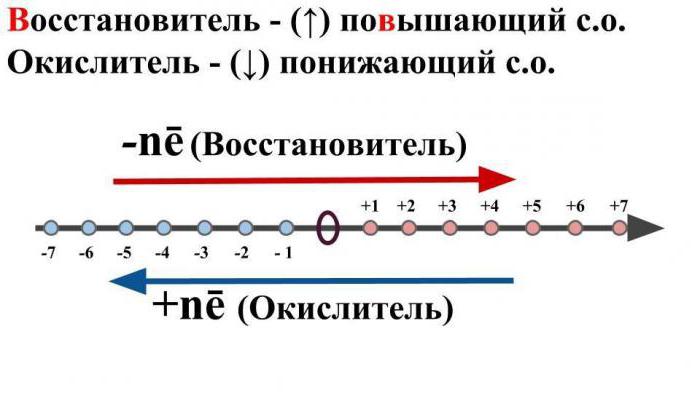
Ar oksidēšanu ir domāta šāda ķīmiska vielareakcija, kurā atoms vai īpašs jons atmest elektronus, vienlaikus pazeminot sākotnējo oksidācijas stāvokli. Šis process ir raksturīgs metāliem.
Ar atgūšanas procesu ir domātsķīmisko pārveidojumu, kā rezultātā elektronu pievienošana samazinās jonu vai vienkāršās vielas oksidēšanās pakāpi. Šī reakcija ir raksturīga nemetāla un skābes atlikumiem.

Ņemot vērā jautājumu par to, kas ir OVR, nav iespējams ignorēt tādu lietu kā "reducējošais aģents".
Ar to tiek saprasta neitrāla molekula vaiuzlādēts jons, kas ķīmiskās mijiedarbības rezultātā ziedo elektronu citam jonam vai atoms, vienlaikus palielinot oksidācijas pakāpi.

Ir svarīgi arī saprast, kas ir iadpieminēt tādu terminu kā "oksidētājs". Zem tā ir parasts pieminēt tādus jonus vai neitrālos atomus, kas ķīmiskās mijiedarbības laikā pieņems negatīvus elektronus no citiem atomiem vai neitrālajām daļiņām. Turklāt tā sākotnējais oksidācijas stāvoklis samazināsies.
Ir jāpaskaidro, kādi ir šie procesi, kurus visbiežāk izmanto neorganiskajā un organiskajā sintēzē.
Mijiedarbība starp molekulām liecina par šāduprocesi, kuros redukcijas aģenta un oksidējošā aģenta atomi atrodas dažādos starojuma materiālos, kas mijiedarbojas. Kā šāda veida transformācijas piemēru var minēt mungāņu oksīda (4) un sālsskābes šķīduma mijiedarbību, kā rezultātā rodas hlora gāze, divvalentais mangāna hlorīds, kā arī ūdens.
Ķīmiskajā procesā, kas tiek izskatīts, kāreducējošais aģents parādās hloru anjoni, oksidēti kā mijiedarbība. Reakcijā oksidēšanās spējas, kas saistītas ar diviem elektroniem, samazinās ar mangāna katijonu (ar oksidācijas stāvokli +4).
Intramolekulāra mijiedarbība irir tādas ķīmiskas transformācijas, kuru mērā gan reducējošā aģenta atomi, gan oksidējošā aģenta atomi sākotnēji ir viens un tas pats izejmateriāls, un pēc transformācijas pabeigšanas tās izrādās dažādos reakcijas produktos.
Kā piemēru šāda veida reakcija varieviest kālija hlorāta sadalījumu. Sildot šo vielu pārveido par kālija hlorīdu un skābekli. Oksidējošās īpašības būs raksturīgas hlorāta anijonam, kas, reaģējot piecus elektronus, samazināsies, pārvēršot hlorīdā.
Šajā gadījumā parādīsies skābekļa anijonssamazinot īpašības, oksidējoties līdz molekulārajam skābeklim. Tātad, kas šajā gadījumā ir vajadzīgs? Šis ir elektronu pārneses process starp joniem, izraisot divu reakcijas produktu veidošanos.
Arī šāda veida ķīmiskās transformācijas,Amonija nitrīta sadalīšanās process ir saistīts ar elementu oksidācijas pakāpes izmaiņām sākotnēji tajā pašā formā. Slāpeklis, kas atrodas amonija katjonā ar oksidācijas stāvokli -3, procesa laikā dod sešus elektronus un oksidējas uz molekulāro slāpekli. Un šis slāpeklis, kas ir daļa no nitrīta, pieņem sešus elektronus, kamēr tas ir reducējošs līdzeklis, un reakcijas laikā tas oksidējas.
Kas ir IAD ķīmijā? Iepriekšminētā definīcija norāda, ka šīs transformācijas ir saistītas ar izmaiņām vairākos oksidācijas stāvokļu elementos.
Pašoksidācija un reģenerācija (nelīdzsvarotība)ietver šādus procesus, kuru laikā viens sākotnējais atoms darbojas kā reducētājs un oksidētājs, kas pēc mijiedarbības pabeigšanas palielinās un vienlaikus samazinās tā oksidācijas stāvokli. Apspriežot, kas OVR ir ķīmijā, šādu pārvērtību piemērus var atrast pat vidusskolas ķīmijas kursos. Kālija sulfīta sadalīšanās karsējot noved pie šī metāla divu sāļu veidošanās: sulfīda un sulfāta. Sēram ar oksidācijas pakāpi +4 piemīt gan reducējošas, gan oksidējošas īpašības, palielinot un samazinot oksidācijas stāvokli.
Lai saprastu, ko OVR nozīmē ķīmijā, aicināmvēl viena veida ķīmiskās transformācijas. Pretproporcionācija ietver tādus procesus, kuru rezultātā reducētāja un oksidētāja atomi atrodas dažādos sākotnējos komponentos, bet labajā daļā tie veido vienu reakcijas produktu. Piemēram, sēra oksīda (4) mijiedarbība ar sērūdeņradi radīs sēru un ūdeni. Sēra jonu ar +4 oksidācijas stāvokli pieņems četri elektroni, bet sēra jonu ar -2 zaudēs divus elektronus. Rezultātā abi no tiem kļūst par vienkāršu vielu, kurā oksidācijas pakāpe ir nulle.

Ņemot vērā jautājumu par to, kas ir OVR ķīmijā,Mēs atzīmējam, ka šīs ir daudzas transformācijas, pateicoties kurām dzīvo organismu funkcija, dažādi dabiskie procesi un parādības rodas. Lai sakārtotu koeficientus šādos vienādojumos, nepieciešams veikt elektronisko līdzsvaru.


























