
De eenvoudigste organische verbindingen zijn verzadigde en onverzadigde koolwaterstoffen. Deze omvatten stoffen van de klasse van alkanen, alkynen, alkenen.

Hun formules bevatten waterstof- en koolstofatomen in een specifieke volgorde en hoeveelheid. Ze komen vaak voor in de natuur.
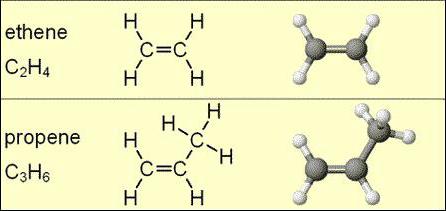
Hun andere naam is alkenen of ethyleenkoolwaterstoffen. Zo heette deze klasse van verbindingen in de 18e eeuw toen een olieachtige vloeistof - ethyleenchloride - werd ontdekt.
Alkenen bevatten stoffen die bestaan uitwaterstof- en koolstofelementen. Ze zijn geclassificeerd als acyclische koolwaterstoffen. In hun molecuul is er een enkele dubbele (onverzadigde) binding die twee koolstofatomen met elkaar verbindt.
Elke klasse van verbindingen heeft zijn eigen chemische aanduiding. Daarin geven de symbolen van de elementen van het periodieke systeem de samenstelling en structuur van de binding van elke stof aan.

De algemene formule voor alkenen wordt als volgt aangegeven: CnX2n, waarbij het getal n groter dan of gelijk aan 2 is. Bij het ontcijferen is het duidelijk dat er voor elk koolstofatoom twee waterstofatomen zijn.
Moleculaire formules van homologe alkenen worden weergegeven door de volgende structuren: C2X4C3X6, C4X8C5X10C6X12C7X14C8X16C9X18C10X20... Te zien is dat elke volgende koolwaterstof nog een koolstof en nog twee waterstof bevat.
Er is een grafische aanduiding van de locatie en volgorde van chemische verbindingen tussen atomen in een molecuul, die de structuurformule van alkenen laat zien. Met behulp van valentie-streepjes wordt de binding tussen koolstoffen en waterstofatomen aangegeven.
Alkenen structuurformule kan worden afgebeeldin uitgebreide vorm, wanneer alle chemische elementen en bindingen worden getoond. De beknoptere uitdrukking voor olefinen toont niet de verbinding van koolstof en waterstof met valentie-streepjes.
De skeletformule geeft de eenvoudigste structuur aan. De onderbroken lijn vertegenwoordigt de basis van het molecuul, waarin de koolstofatomen worden weergegeven door de boven- en uiteinden, en de schakels geven waterstof aan.
Gebaseerd op de systematische nomenclatuur, de formulealkenen en hun namen zijn samengesteld uit de structuur van alkanen gerelateerd aan verzadigde koolwaterstoffen. Om dit te doen, in de naam van de laatste, wordt het achtervoegsel -an vervangen door -ilen of -en. Een voorbeeld is de vorming van butyleen uit butaan en penteen uit pentaan.
Om de positie van een dubbele binding ten opzichte van koolstofatomen aan te geven, geeft u aan het einde van de naam een Arabisch cijfer op.
De naam van alkenen is gebaseerd op de notatiede koolwaterstof met de langste keten waarin een dubbele binding aanwezig is. Voor het begin van de kettingnummering wordt meestal het einde gekozen dat het dichtst bij de onverzadigde verbinding van koolstofatomen ligt.
Als de structuurformule van alkenen heefttakken, geef vervolgens de namen van de radicalen en hun nummer aan, en ervoor staan nummers die overeenkomen met de plaats in de koolstofketen. Daarna volgt de naam van de koolwaterstof zelf. De cijfers worden meestal gevolgd door een koppelteken.
Er zijn onverzadigde radicale takken. Hun namen kunnen triviaal zijn of zijn gevormd volgens de regels van de systematische nomenclatuur.
HNC = CH- wordt bijvoorbeeld ethenyl of vinyl genoemd.
Moleculaire formules van alkenen kunnen niet op isomerisme duiden. Echter, voor deze klasse van stoffen, met uitzondering van het ethyleenmolecuul, is ruimtelijke modificatie inherent.
Isomeren van ethyleenkoolwaterstoffen kunnen koolstofskeletten, onverzadigde bindingsposities, interklassen of ruimtelijk zijn.
De algemene formule van alkenen bepaalt het bedragkoolstof- en waterstofatomen in de keten, maar het toont niet de aanwezigheid en locatie van de dubbele binding. Een voorbeeld is cyclopropaan als een interklasse-isomeer van C3X6 (propyleen). Andere soorten isomerisme komen voor in C4X8 of buteen.
Een andere positie van onverzadigde verbinding wordt waargenomen inbuteen-1 of buteen-2, in het eerste geval bevindt de dubbele verbinding zich nabij het eerste koolstofatoom en in het tweede - in het midden van de keten. Met behulp van methylpropeen (CH3-C (CH3) = H2) en isobutyleen ((CH3) 2C = CH2).
Ruimtelijke modificatie is inherent aan buteen-2 intrans en cis positie. In het eerste geval bevinden zijradicalen zich boven en onder de hoofdketen van koolstof met een dubbele binding, in het tweede isomeer bevinden de substituenten zich aan één kant.
De algemene formule van alkenen bepaalt de fysieke conditie van alle vertegenwoordigers van deze klasse. Beginnend met ethyleen en eindigend met butyleen (vanaf C2 tot C4), stoffen bestaan in gasvorm. Kleurloos etheen heeft dus een zoete geur, een lage oplosbaarheid in water en het molecuulgewicht is minder dan dat van lucht.
In vloeibare vorm, koolwaterstoffen met een homoloog interval vanaf C5 tot C17... Beginnend met een alkeen, dat 18 koolstofatomen in de hoofdketen heeft, vindt er een overgang van de fysieke toestand naar een vaste vorm plaats.
Alle olefinen worden beschouwd als slecht oplosbaar inwateromgeving, maar goed in organische oplosmiddelen, zoals benzeen of benzine. Hun molecuulgewicht is minder dan dat van water. Een toename van de koolstofketen leidt tot een toename van temperatuurindicatoren tijdens het smelten en koken van deze verbindingen.
De structuurformule van alkenen toont de aanwezigheid inhet skelet van een dubbele binding van π- en σ- verbindingen van twee koolstofatomen. Deze structuur van het molecuul bepaalt de chemische eigenschappen ervan. De π-binding wordt als niet erg sterk beschouwd, waardoor deze kan worden vernietigd door de vorming van twee nieuwe σ-bindingen, die worden verkregen als gevolg van de aanhechting van een paar atomen. Onverzadigde koolwaterstoffen zijn elektronische donoren. Ze nemen deel aan elektrofiele hechtingsprocessen.

Een belangrijke chemische eigenschap van alle alkenen iseen halogeneringsproces waarbij verbindingen vrijkomen die vergelijkbaar zijn met dihalogeenhoudende stoffen. Halogeenatomen zijn in staat tot dubbele binding aan koolstofatomen. Een voorbeeld is de bromering van propyleen tot 1,2-dibroompropaan:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Dit proces van neutraliseren van kleur in broomwater met alkenen wordt beschouwd als kwalitatief bewijs van de aanwezigheid van een dubbele binding.
De belangrijke reacties zijn onder meer de hydrogenering van olifinenmet toevoeging van een waterstofmolecuul onder invloed van katalytische metalen zoals platina, palladium of nikkel. Het resultaat is koolwaterstoffen met een verzadigde binding. Formules van alkanen, alkenen worden hieronder gegeven in de hydrogeneringsreactie van buteen:
B3–CH2–CH = CH2 + H2 Geen van beide→ CH3–CH2–CH2–CH3.
Het proces om een waterstofhalogenidemolecuul aan olefinen te hechten wordt genoemd
hydrohalogenatie, volgens de regel,ontdekt door Markovnikov. Een voorbeeld is de hydrobromering van propyleen tot 2-broompropaan. Daarin combineert waterstof met een dubbele binding met koolstof, die als de meest gehydrogeneerde wordt beschouwd:
B3–CH = CH2 + HBr → CH3–BrCH - CH3.
De reactie van toevoeging van water door alkenen onder invloed van zuren wordt hydratatie genoemd. Het resultaat is een propanol-2-alcoholmolecuul:
B3–HC = CH2 + H2O → CH3–OHCH - CH3.
Wanneer alkenen worden blootgesteld aan zwavelzuur, vindt het sulfoneringsproces plaats:
B3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2−OH.
De reactie vindt plaats onder vorming van zure esters, bijvoorbeeld isopropylzwavelzuur.
Alkenen zijn onderhevig aan oxidatie tijdens hun verbranding onder invloed van zuurstof met de vorming van water en koolstofdioxidegas:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
De interactie van olefinische verbindingen enverdund kaliumpermanganaat in de vorm van een oplossing leidt tot de vorming van glycolen of diatomaire alcoholen. Deze reactie is ook oxidatief met de vorming van ethyleenglycol en verkleuring van de oplossing:
3x2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2 KOH.
Alkenemoleculen kunnen betrokken zijn bij polymerisatie met een vrije radicaal of kationisch-anionisch mechanisme. In het eerste geval wordt onder invloed van peroxiden een polymeer van het polyethyleen-type verkregen.
Volgens het tweede mechanisme werken zuren als kationische katalysatoren en zijn organometallische stoffen anionisch, met afgifte van een stereoselectief polymeer.
Ze worden ook wel paraffines of beperkend genoemdacyclische koolwaterstoffen. Ze hebben een lineaire of vertakte structuur, die alleen verzadigde enkelvoudige bindingen bevat. Alle vertegenwoordigers van de homologe reeks van deze klasse hebben de algemene formule CnX2n + 2.
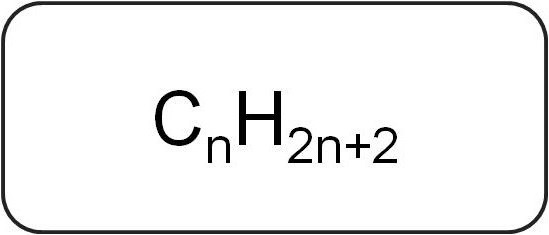
Ze bevatten alleen koolstof- en waterstofatomen. De algemene formule voor alkenen is afgeleid van de notatie van verzadigde koolwaterstoffen.
De eenvoudigste vertegenwoordiger van deze klasseis methaan. Het wordt gevolgd door stoffen zoals ethaan, propaan en butaan. Hun naam is gebaseerd op de wortel van het nummer in het Grieks, waaraan het achtervoegsel -an is toegevoegd. Alkaannamen worden vermeld in de IUPAC-nomenclatuur.
De algemene formule voor alkenen, alkynen, alkanen omvatslechts twee soorten atomen. Deze omvatten de elementen koolstof en waterstof. Het aantal koolstofatomen in alle drie de klassen is hetzelfde, het verschil wordt alleen waargenomen in het aantal waterstof, dat kan worden afgesplitst of gehecht. Onverzadigde verbindingen worden verkregen uit verzadigde koolwaterstoffen. Vertegenwoordigers van paraffinen in het molecuul bevatten 2 waterstofatomen meer dan olefinen, wat wordt bevestigd door de algemene formule van alkanen, alkenen. De alkenenstructuur wordt als onverzadigd beschouwd vanwege de aanwezigheid van een dubbele binding.
Als we het aantal waterstof- en koolstofatomen in alkanen correleren, dan is de waarde maximaal in vergelijking met andere klassen koolwaterstoffen.
Beginnend met methaan en eindigend met butaan (vanaf C.1 tot C4), stoffen bestaan in gasvorm.
In vloeibare vorm, koolwaterstoffen met een homoloog interval vanaf C5 tot C16... Beginnend met een alkaan, dat 17 koolstofatomen in de hoofdketen heeft, vindt een overgang van de fysische toestand naar een vaste vorm plaats.
Ze worden gekenmerkt door isomerie in het koolstofskelet en optische modificaties van het molecuul.

Bij paraffines wordt rekening gehouden met koolstofvalentiesvolledig bezet door naburige koolstofatomen of waterstofatomen om een σ-type binding te vormen. Vanuit chemisch oogpunt bepaalt dit hun zwakke eigenschappen, daarom worden alkanen verzadigde of verzadigde koolwaterstoffen genoemd, zonder affiniteit.
Ze treden in substitutiereacties in verband met radicale halogenering, sulfochlorering of nitratie van het molecuul.
Paraffines ondergaan oxidatie, verbranding of ontbinding bij hoge temperaturen. Onder invloed van reactieversnellers worden waterstofatomen geëlimineerd of alkanen gedehydrogeneerd.
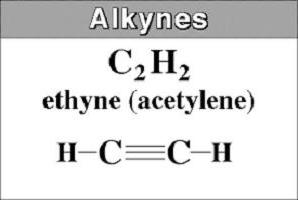
Ze worden ook wel acetylenische koolwaterstoffen genoemd, die een drievoudige binding hebben in de koolstofketen. De structuur van alkynen wordt beschreven door de algemene formule CnX2n - 2... Het toont aan dat acetylenische koolwaterstoffen, in tegenstelling tot alkanen, vier waterstofatomen missen. Ze worden vervangen door een drievoudige binding gevormd door twee π-verbindingen.
Deze structuur bepaalt de chemische eigenschappen van deze klasse. De structuurformule van alkenen en alkynen laat duidelijk de onverzadiging van hun moleculen zien, evenals de aanwezigheid van een dubbele (H2C꞊CH2) en drievoudige (HC≡CH) bindingen.
De eenvoudigste vertegenwoordiger is acetyleenof HC≡CH. Het wordt ook wel ethine genoemd. Het komt van de naam van een verzadigde koolwaterstof, waarin het achtervoegsel -an is verwijderd en -in is toegevoegd. In de namen van lange alkynen geeft het nummer de locatie van de drievoudige binding aan.
Зная строение углеводородов насыщенных и onverzadigd is het mogelijk om te bepalen onder welke letter de algemene formule van alkynen wordt aangeduid: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. De derde optie is het juiste antwoord.
Beginnend met acetyleen en eindigend met butaan (vanaf C.2 tot C4), stoffen zijn gasvormig.
In vloeibare vorm zijn er koolwaterstoffen met het homologe interval van C5 tot C17... Beginnend met alkyn, dat 18 koolstofatomen in de hoofdketen heeft, vindt een overgang van de fysische toestand naar een vaste vorm plaats.
Ze worden gekenmerkt door isomerie in het koolstofskelet, in de positie van de drievoudige binding, en door interklassemodificaties van het molecuul.
Qua chemische eigenschappen lijken acetyleenkoolwaterstoffen op alkenen.
Als alkyn een terminale drievoudige binding heeft, dan zijn zevervullen de functie van een zuur met de vorming van alkynidezouten, bijvoorbeeld NaC≡CNa. De aanwezigheid van twee π-bindingen maakt het natriumacetyledine-molecuul tot een sterk nucleofiel dat substitutiereacties aangaat.
Acetyleen ondergaat chlorering in aanwezigheid van koperchloride om dichlooracetyleen te verkrijgen, condensatie onder invloed van halogeenalkynen met de afgifte van diacetyleenmoleculen.
Alkines zijn betrokken bij additiereactieselektrofiel, waarvan het principe de basis is van halogenering, hydrohalogenering, hydratatie en carbonylering. Dergelijke processen zijn echter zwakker dan die van alkenen met een dubbele binding.
Voor acetylenische koolwaterstoffen zijn nucleofiele additiereacties van het alcohol-, primaire amine- of waterstofsulfidemolecuul mogelijk.


























