
De waarde van de waterstofindex speelt een belangrijke rolrol voor vele chemische en biologische transformaties die zowel in laboratoria als in productie plaatsvinden, en in levende organismen en het milieu. De hoeveelheid waterstofionen heeft niet alleen invloed op het resultaat van een reactie, maar ook op de mogelijkheid van optreden. Om een bepaalde pH-waarde te behouden, worden bufferoplossingen gebruikt. Hun taak is om dit niveau te behouden bij het verdunnen van oplossingen of het toevoegen van zuren en logen.
Water pH is een van de tekenenwaterkwaliteit voor verschillende doeleinden. In de natuur zijn de ontwikkeling van planten, de agressiviteit van de omgeving op metalen en betonnen constructies ervan afhankelijk. Er moet aan worden herinnerd dat de waterstofindicator de toxiciteit van verontreinigende stoffen voor organismen in rivieren, meren en vijvers verandert.

Deze parameter karakteriseert de inhoud van ionen Η+ in oplossingen. Het wordt aangegeven door pH. Wiskundig gezien is de pH gelijk aan de inverse decimale logaritme van concentratie Η+ (CH +, mol / L): pΗ = −lgCH +. De hoeveelheid H + -ionen in water wordt bepaald door de dissociatie van H-moleculen2Over het voorkomen, volgens de uitdrukking: N2O <–> N+ + OH-.
Ondanks het feit dat water niet vaak elektrolyten wordt genoemd, is het een laag-dissociërende stof. Daarvoor kun je de dissociatieconstante schrijven: Kd= (CH +·VANHIJ-)/VANH2O... Bij t = 22 ° C is de waarde 1,8ˑ10-16.
Dit cijfer is zo klein dat ionen Η+ en hij- in het water zou kunnen worden verwaarloosd. Maar in de chemie van oplossingen is de pH-waarde van toepassing om een pH-schaal te creëren. Laten we eens kijken naar de betekenis ervan.
Met zijn hulp kunt u de zuurgraad van een oplossing kwantitatief uitdrukken.
| PΗ-waarde | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | veertien |
| Kwaliteit van de omgeving | zuur | neutrale | alkalisch |
De pH van het medium is eenvoudig te berekenen. U hoeft alleen de concentratie waterstofkationen te kennen en de formule te gebruiken: Cn + = 10n, waarbij n de pH-waarde is met het tegenovergestelde teken. Bijvoorbeeld de concentratie van H.+ in oplossing is CH + = 10-vijf mol / l. Dat wil zeggen, n = –5 en pH = 5.

Alles in de menselijke omgeving heeft zijn eigen omgevingbepaalde pH-waarden. Dit helpt verschillende lichaamssystemen om hun taken gemakkelijker uit te voeren. Zoals u weet, is voor zuiver neutraal water de pH-waarde 7. De menselijke huid reageert echter licht zuur. Hun pH = 5,5. Dit feit beïnvloedt gedeeltelijk het uiterlijk van een droge huid bij veelvuldig contact met water. Hieronder staan de pH-waarden voor enkele stoffen.
| Ten gronde | pΗ |
| Batterij elektrolyt | <1,0 |
| Maagsap | 1.0-2.0 |
| Citroensap | 2,0 |
| Tafelazijn | 2,4 |
| Cola | 3,0 |
| appelsap | 3,0 |
| Koffie | 5,0 |
| Shampoos | 5,5 |
| Zwarte thee | 5,5 |
| Menselijke huid | 5,5 |
| Zure regen | <5.6 |
| Speeksel | 6,5 |
| melk | 6,7 |
| Water | 7,0 |
| Bloed | 7,36 |
| Zeewater | 8,0 |
| Vaste zeep | 9,5 |
| Bleekmiddel (bleekmiddel) | 12,5 |
Waterige oplossingen, zoals hierboven al vermeld, kunnen dat weleen neutrale, zure of alkalische reactie van de omgeving hebben. Het feit dat de zuurgraad van een oplossing te wijten is aan de aanwezigheid van H + -ionen, en de alkaliteit - tot OH-ionen, betekent niet dat ze geen andere bevatten. In zure media is het mogelijk om een overmaat aan waterstofionen te detecteren, en in alkalische media een overmaat aan hydroxide-ionen.
In neutrale oplossingen is de pH 7. Dit betekent dat de concentratie van H-kationen+ in hen is 10–7 mol / l, maar tegelijkertijd is het gehalte aan hydroxide-anionen ook 10–7 mol / l. Met andere woorden, in neutrale oplossingen is er geen overmaat aan Η + of ОΗ- ionen.
Waarom kan de pH variëren van 1 tot 14? Om deze vraag te beantwoorden, is het de moeite waard om terug te keren naar de uitdrukking voor de dissociatieconstante. Door het te transformeren, kun je K schrijvend·VANH2O= CH +·VANHIJ-... De Kd-waarde is bekend en de concentratie van watermoleculen kan eenvoudig worden berekend. Water beschouwen als een oplossing van H2O in N2Oh, je kunt de molaire concentratie achterhalen door de verhouding samen te stellen: 18 g H2O - 1 mol, 1000 g H2Oh - x mol. Dus x = 1000/18 = 55,6 mol / l. Deze constante wordt aangeduid met Kin en wordt het ionische product van water genoemd.
Vervolgens vermenigvuldigen we de waarde van Kd door de gevonden waarde: 55,6 1,8ˑ10-zestien= CΗ +·VANОΗ–; tien-veertien = CΗ +·VANОΗ–... Dat wil zeggen, we kunnen schrijven: Kin= CΗ +·VANОΗ– = 10-veertien.
Met deze waarde konden we concluderen dat pΗ + pOΗ = 14, wat het antwoord is op de bovenstaande vraag.
Alle sterke zuren in water dissociëren onomkeerbaar. Zoutzuur valt dus volledig uiteen in kationen Η+ en chloride-anionen Cl-: ΗCl = Η++ Cl-... Als 1ˑ10-2 mol ΗCl, dan is de concentratie van ionen Η+ zal ook gelijk zijn aan 1.10-2 mοl. Dat wil zeggen, voor een dergelijke oplossing is de pH 2.
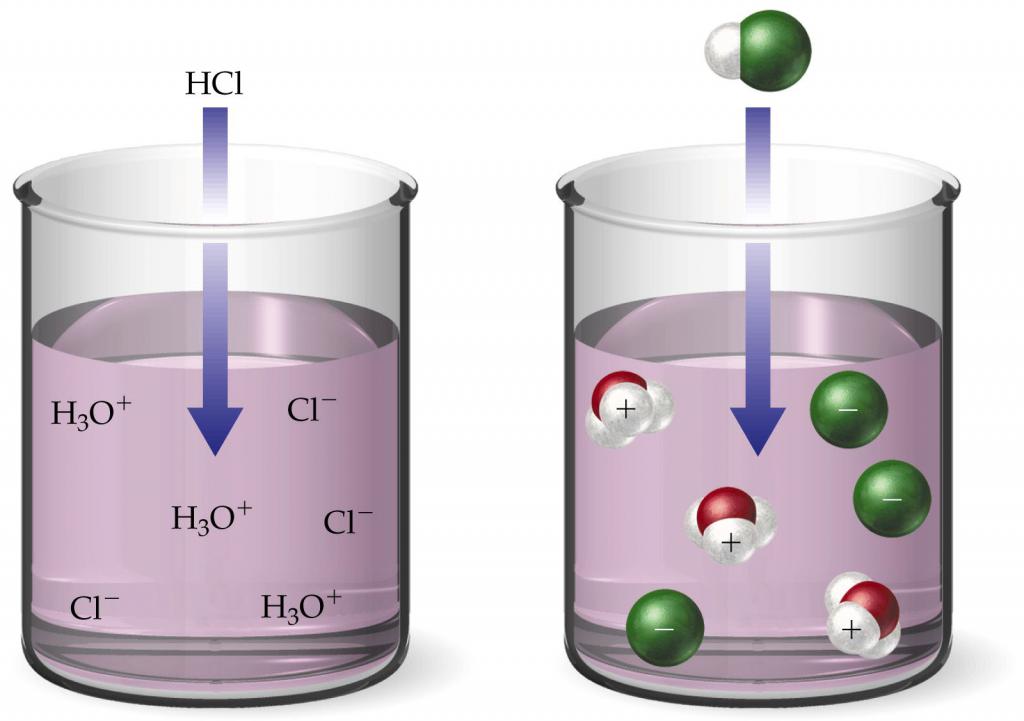
Zwakke zuren dissociëren omkeerbaar, dat wil zeggen,Net als in het geval van water combineren sommige van de tegengesteld geladen ionen zich weer om zuurmoleculen te vormen. Koolzuur valt bijvoorbeeld uiteen in de volgende ionen: Η2Met3 <–> Η++ ΗCO3-... Niet alleen dissociëren niet alle moleculen, maar de uiteengevallen moleculen vormen weer één geheel. Om de pH van zuren te vinden, wordt daarom de dissociatieconstante gebruikt.
Daarnaast kan de pH van de oplossing worden gebruikt om indirect de sterkte van het zuur te schatten: hoe hoger, hoe lager de pΗ-waarde.
Wanneer basen worden opgelost in water, beginnen zedissociatie met het verschijnen van hydroxide-anionen. Ze interageren met H + -ionen, die aanwezig zijn in neutraal zuiver water. Dit leidt tot een afname van hun concentratie, dat wil zeggen tot een toename van de pH.
Bijvoorbeeld: NaOΗ = Na++ OΗ-; Η++ OΗ-= Η2O.
In een natriumhydroxide-oplossing met een concentratie van 1-10-2 mol / l 1ˑ10 verschijnt-2 mol / l hydroxide-anionen. Kationconcentratie Η+ in zo'n oplossing zal gelijk zijn aan 1ˑ10-12 mol / l, en pΗ heeft een waarde van 12.
In alle basisoplossingen is het aantal kationen Н+ altijd minder dan 1ˑ10-7 mol / l, en de pH is groter dan 7.

Een van de gemakkelijkste manieren om te benaderenbepaal p van de oplossing - gebruik de strips van de universele indicator. Door hun kleur te vergelijken met de indicatorschaal, die verschijnt na onderdompeling in de werkende oplossing, is het mogelijk om de concentratie van ionen te schatten Η+... Een universele indicator is een mengsel van verschillende stoffen waarvan de kleur opeenvolgend verandert van rood naar paars (zoals in een regenboog) bij afnemende zuurgraad.
De belangrijkste nadelen van deze methode zijn de onmogelijkheid om de pH in gekleurde of troebele oplossingen te bepalen, evenals een geschatte schatting van de ionenconcentratie Η+ in oplossing.
Voor een nog grovere bepaling van de pH van het mediumpas verschillende indicatoren toe. De meest gebruikte zijn lakmoes, methyloranje, fenolftaleïne en andere. Door hun kleur te veranderen, kan men alleen te weten komen of de onderzochte samenstelling zuur, alkalisch of neutraal is.
| Indicator | pΗ <7 | pΗ = 7 | pΗ> 7 |
| Lakmoes | rood | paars | blauw |
| Fenolftaleïne | kleurloos | kleurloos | framboos |
| Methyl oranje | roze | oranje | geel |
Een veel nauwkeurigere waarde van de ionenconcentratie Η+, en, bijgevolg, p the van de oplossing, kan worden gevonden metmet behulp van een pH-meter. Deze analysemethode wordt potentiometrisch genoemd. Het is gebaseerd op het meten van de elektrodepotentiaal en het bepalen van de relatie tussen de waarde en de concentratie van de component in de testoplossing. De elektrodepotentiaal komt voort uit een elektrochemisch proces dat plaatsvindt op het grensvlak van metaaloplossing.

Voor de meting, make-upeen galvanische cel van twee halve cellen met elektroden, waarvan de potentiaal op voorhand bekend is. Vervolgens wordt de EMF gemeten. Meestal wordt de pH-bepaling in waterige oplossingen uitgevoerd met behulp van zilverchloride en glaselektroden. De eerste is de referentie-elektrode. De waarde van het potentieel van de tweede hangt af van de ionenconcentratie Η+ in oplossing.
Ook wordt de pH-waarde in laboratoria bepaaldcolorimetrisch. Deze methode is gebaseerd op het vermogen van tweekleurige indicatoren om hun kleur of kleurintensiteit te veranderen, afhankelijk van het gehalte aan waterstofkationen. De kleur die in de oplossing verschijnt, wordt vergeleken met een standaardschaal, die is samengesteld op basis van gegevens van oplossingen met een bekende pH-waarde.
Ze zijn als volgt:
1. Voor de productie van producten met gewenste eigenschappen. Tijdens het productieproces wordt afgeweken vantechnologische pH-waarde kan storingen veroorzaken die leiden tot een verandering in de eigenschappen van het product. Deze indicatoren kunnen smaak of uiterlijk zijn.
2. Om de kosten te verlagen. In sommige industrieën hangt de productopbrengst direct of indirect af van de pH van het reactiemedium. Dienovereenkomstig, hoe hoger de opbrengst van het reactieproduct, hoe lager de kosten.
3. Om arbeid of milieu te beschermen. Omdat veel verbindingen hun schadelijke eigenschappen pas bij een bepaalde pH vertonen, is het erg belangrijk om de waarde ervan te beheersen.
4. Om ervoor te zorgen dat het product voldoet aan de normen. In veel normatieve documenten standaardiserende kwaliteit van een product, product, medicijn etc. is er een lijst met indicatoren waaraan ze moeten voldoen. Een daarvan is de pH. Zo draagt de definitie ervan tot op zekere hoogte bij tot de bescherming van de bevolking tegen schadelijke stoffen.
5. Om apparatuur te beschermen. De meeste productieapparatuur,die in contact komt met chemicaliën is onderhevig aan corrosie. De snelheid van zijn ontwikkeling is sterk afhankelijk van de pH-waarden. Met andere woorden, pH-meting is belangrijk om productieapparatuur te beschermen tegen onnodige schade.

6. Voor onderzoeksdoeleinden. De pH-waarde is belangrijk voor het bestuderen van verschillende biochemische processen. Het wordt ook gemeten voor medische doeleinden om een bepaalde diagnose te bevestigen.
Voor de berekende bepaling van de pH van een oplossing zijn gegevens over de molaire concentratie van kationen nodig Η+ of OΗ--anion. Als ze bekend zijn, kun je meteen een van de formules gebruiken:
De concentratie van een ion in mol / L in een elektrolytoplossing is gemakkelijk te achterhalen door de vergelijking:
Cm ion = CmˑΑˑ⋅n, waar:
Cm ion en Cm - molaire concentraties van respectievelijk ion en elektrolyt (mol / l).
α-graad van dissociatie.
n is het aantal ionen van het beschouwde type, dat wordt gevormd tijdens het verval van slechts één elektrolytmolecuul.
De mate van dissociatie van zwakke elektrolyten kan worden bepaald door de Ostwald-verdunningswet: α = √ (Kd/VANm).
1. Het is vereist om de pH van 0,001N NaOH-oplossing te berekenen.
Oplossing: aangezien natriumhydroxide een sterke elektrolyt is, is de dissociatie ervan in waterige oplossing onomkeerbaar. Hieruit volgt de vergelijking: NaOΗ → Na + OΗ.
We gebruiken de formule Cm ion = CmˑΑˑn. We nemen de dissociatiegraad gelijk aan 1. Wanneer één NaOH-molecuul wordt vernietigd, wordt één OH-ion gevormd, wat n = 1 betekent. VANm bekend door de probleemstelling en gelijk aan 0,001 of 10-3... Vandaar COH-= 10-3ˑ1ˑ1 = 10-3.
De concentratie van Η + ionen kan worden bepaald uit de relatie Kin= CΗ +·VANОΗ– = 10-veertien... Als we de formule transformeren, krijgen we CH += Kin/VANОΗ–= 10-veertien/tien-3= 10-elf... Vervolgens kunnen we de pH berekenen: рΗ = -lg10-11= 11.
Antwoord: pH = 11.

2. Het is vereist om [Η+] en [OH-], indien in een gegeven oplossing pH = 4,3.
Oplossing: Het is het gemakkelijkst om eerst de concentratie waterstofkationen te vinden: [Η+] = 10-pΗ = 10-4,3 = 5-10-5 mol / l.
Het is gemakkelijk om de concentratie van hydroxide-anionen te vinden uit de verhouding van het ionische product van water: COΗ-= Kin/VANΗ += 10-veertien/ 5ˑ10-5= 2ˑ10-10 mol / l.
Antwoord: 5-10-5 mol / l en 2ˑ10-10 mol / l.


























