
Chemická väzba je väzba medzi dvoma alebo viacerými atómami (molekulami) v organickej alebo anorganickej zlúčenine. Vzniká pod podmienkou zníženia celkovej energie v systéme.
Všetky prvky periodickej tabuľky sa líšiaschopnosť formovať komunikáciu. Najstabilnejšie a vo výsledku chemicky neaktívne sú atómy vzácnych (inertných) plynov, pretože na vonkajšom elektrónovom obale obsahujú dva alebo osem elektrónov. Tvoria malý počet väzieb. Napríklad neón, hélium a argón netvoria chemické väzby so žiadnymi prvkami, zatiaľ čo xenón, kryptón a radón môžu reagovať s molekulami fluóru a vody.
Pre atómy iných prvkov nie sú vonkajšie úrovne dokončené a majú jeden až sedem elektrónov, preto kvôli zvýšeniu stability škrupín vytvárajú chemické väzby.
Existuje niekoľko druhov komunikácie:
Tento typ väzby sa vytvára medzi atómami vmolekula v dôsledku socializácie alebo prekrytia valenčného elektrónového páru. Podľa toho existujú mechanizmy výmeny (a) a donor-akceptor (b) na vytvorenie kovalentnej väzby. Samostatným prípadom je datívny zväzok, o ktorom sa bude diskutovať nižšie.

Atómy na vonkajšej úrovni sú nespárovanéelektróny. Pri interakcii sa vonkajšie škrupiny prekrývajú. Antiparalelné rotácie jednotlivých elektrónov obsiahnuté vo vonkajšej dvojici tvoria elektronový pár spoločný pre oba atómy. Tento pár elektrónov je v skutočnosti kovalentná väzba, ktorá je tvorená mechanizmom výmeny napríklad v molekule vodíka.
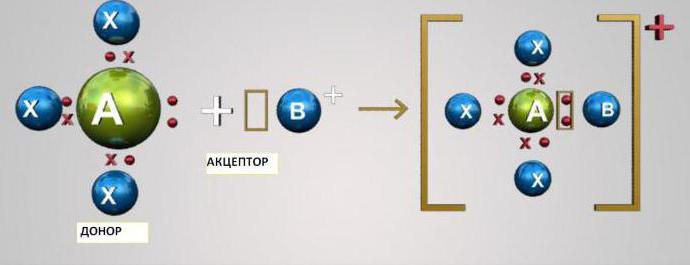
Tento mechanizmus spočíva v socializáciidva atómy dvoch elektrónov na vonkajšej úrovni. V tomto prípade jeden z atómov pôsobí ako donor (poskytuje dva elektróny) a druhý - akceptor (má prázdny orbitál pre elektróny). Atómy s- a p-prvkov môžu byť buď akceptory, alebo donory elektrónov. Atómy D-prvku môžu byť donormi aj akceptormi.
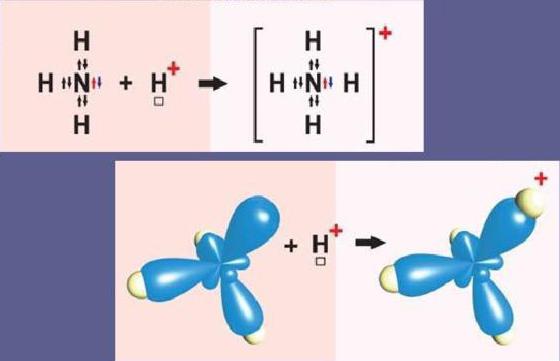
Aby sme pochopili, čo je mechanizmus donor-akceptor, uvažujme o dvoch najjednoduchších príkladoch - tvorba hydróniových katiónov H3ach+ a amónny NH4+.
Schematicky je reakcia tvorby amónnej častice nasledovná:
HH3+ H+= NH4+
Elektróny v atóme dusíka sú distribuované v nasledujúcom poradí: 1s2 2 s2 2 s3.
Elektronická štruktúra katiónu H: 1 s0.
Atóm dusíka na vonkajšej úrovni obsahuje dva s- atri p-elektróny. Tri p-elektróny sa podieľajú na tvorbe troch väzieb kovalentného výmenného typu dusík-vodík N-H. To vedie k tvorbe molekuly amoniaku NH3 s kovalentnou väzbou. Pretože atóm dusíka N na vonkajšej úrovni má pár elektrónov s, NH3 môže pridať aj vodíkový katión. Molekula amoniaku je donor a katión vodíka H+ - akceptor, ktorý prijíma donorové elektróny z dusíka na svoj vlastný voľný s-orbitál.
Elektróny v atóme kyslíka sú distribuované v nasledujúcom poradí: 1s2 2 s2 2 s4.
Atóm kyslíka na vonkajšej úrovni má dve s aštyri p-elektróny. Na základe toho sa dva voľné p-elektróny a dva s-elektróny z dvoch atómov H podieľajú na tvorbe väzieb H-O. To znamená, že v molekule H sú 2 existujúce väzby2O - kovalentný, tvorený výmenným mechanizmom.
Elektronická štruktúra katiónu vodíka: 1 s0.
Pretože atóm kyslíka na vonkajšej úrovnistále existujú dva elektróny (typ s), môže vytvoriť tretiu väzbu kovalentného typu mechanizmom donor-akceptor. Akceptorom môže byť atóm s voľnou dráhou, v tomto príklade je to častica H+... Voľný s-orbitál H+ zaberajú dva elektróny atómu kyslíka.

Mechanizmus donor-akceptor kovalentnej väzbyje možný nielen pri interakciách typu „atóm-atóm“ alebo „molekula-atóm“, ale aj pri reakciách medzi molekulami. Jedinou podmienkou interakcie donor-akceptor kineticky nezávislých molekúl je zníženie entropie, inými slovami, zvýšenie usporiadania chemickej štruktúry.
Zvážte prvý príklad - tvorbu kyseliny aprotovej (Lewisovej kyseliny) NH3Bf3... Tento anorganický komplex vzniká reakciou pridania molekuly amoniaku a fluoridu boritého.
HH3+ BF3= NH3Bf3
Elektróny v atóme bóru sú distribuované v nasledujúcom poradí: 1s2 2 s2 2 s1.
Po excitácii atómu B prejde jeden elektrón typu s na p-podúrovňu (1 s2 2 s1 2 s2). Existujú teda dva s a dva p elektróny na vonkajšej úrovni excitovaného atómu bóru.
V molekule BF3 vzniknú tri kovalentné väzby B-F bóru a fluóruvýmenný typ (atómy bóru a fluóru poskytujú každý po jednom elektróne). Po vytvorení troch kovalentných väzieb v atóme bóru na vonkajšom elektrónovom obale zostáva voľná p-podúroveň, vďaka ktorej môže molekula fluoridu bórového pôsobiť ako akceptor elektrónov.
Elektróny v atóme dusíka sú distribuované v nasledujúcom poradí: 1s2 2 s2 2 s3.
Zúčastňujú sa tri elektróny, každý z N a H atómovtvorba väzby dusík-vodík. Potom má dusík stále dva elektróny typu s, ktoré môžu poskytnúť na vytvorenie väzby mechanizmom donor-akceptor.
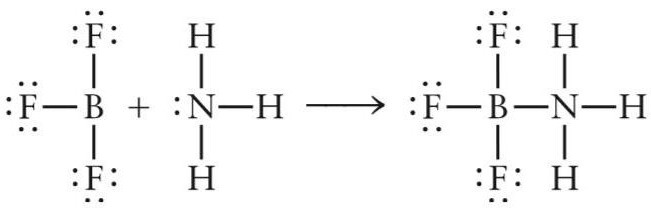
Pri reakcii interakcie fluoridu boritého a amoniaku molekula NH3 hrá úlohu darcu elektrónov a BF3 - akceptor. Pár dusíkových elektrónov zaberá voľný orbitál fluoridu boritého a vzniká chemická zlúčenina NH3Bf3.
Ďalším príkladom mechanizmu vytvárania väzby donor-akceptor je výroba polyméru fluoridu berýlia.
Reakcia je schematicky nasledovná:
BeF2+ BeF2+ ... + BeF2-> (BeF2)n
Elektróny v atóme Be sú usporiadané nasledovne - 1 s2 2 s2a na atóme F - 1 s2 2 s2 2 s5.
Dve väzby berýlium-fluór v molekule fluoridu berýlia sú typu kovalentnej výmeny (sú to dva p-elektróny z dvoch atómov fluóru a dva elektróny s-podúrovne atómu berýlia).
Medzi dvojicou atómov berýlia (Be) a fluóru (F)mechanizmom donor-akceptor sú tvorené ďalšie dve kovalentné väzby. V polyméri fluoridu berýlia je atóm fluóru donor elektrónov, atóm berýlia je ich akceptorom, ktorý má prázdny orbitál.
Keď je spojenie tvorenéna uvažovaný mechanizmus medzi molekulami organickej povahy vznikajú zložitejšie zlúčeniny - komplexy. Akákoľvek organická zlúčenina s kovalentnou väzbou obsahuje obe obsadené (nezáväzné a väzobné) a prázdne orbitaly (uvoľňujúce sa a nezáväzné). Možnosť tvorby komplexov donor-akceptor je určená stupňom stability komplexu, ktorý závisí od sily väzby.
Zvážte príklad - interakčná reakciamolekuly metylamínu s kyselinou chlorovodíkovou za vzniku metylamóniumchloridu. V molekule metylamínu sú všetky väzby kovalentné a sú tvorené mechanizmom výmeny - dve väzby H-N a jedna väzba N-CH.3... Po zmiešaní s vodíkom a metylomskupina, atóm dusíka má pár elektrónov typu s. Ako darca poskytuje tento elektrónový pár pre atóm vodíka (akceptor), ktorý má voľný orbitál.

Nie vo všetkých prípadoch darca-príjemcainterakcia je socializácia elektrónového páru a tvorba väzby. Niektoré organické zlúčeniny sa môžu navzájom kombinovať z dôvodu prekrytia naplneného darcovského orbitálu s prázdnym akceptorovým orbitálom. Nastáva prenos náboja - elektróny sa delokalizujú medzi akceptorom a darcom, ktoré sú veľmi blízko seba. Vznikajú komplexy na prenos náboja (CTC).
Táto interakcia je typická pre pi-systémy,ktorých orbitaly sa ľahko prekrývajú, a elektróny sa ľahko polarizujú. Ako darcovia môžu pôsobiť metalocény, nenasýtené aminozlúčeniny, TDAE (tetrakis (dimetylamino) etylén). Fullerény a chinodimetány s akceptorovými substituentmi sú často akceptormi.
Prevod platby môže byť čiastočný alebo úplný. K prenosu úplného náboja dôjde po fotoexcitácii molekuly. To vytvára komplex, ktorý je možné spektrálne pozorovať.
Bez ohľadu na úplnosť prenosu poplatkov, naprkomplexy sú nestabilné. Na zvýšenie pevnosti a životnosti takéhoto stavu sa dodatočne zavádza mostná skupina. Vďaka tomu sa systémy darcu a príjemcu úspešne používajú v zariadeniach na premenu slnečnej energie.
V niektorých organických molekulách väzbamechanizmus donor-akceptor sa vytvára vo vnútri molekuly medzi donorovou a akceptorovou skupinou. Tento typ interakcie sa nazýva transanulárny efekt, charakteristický napríklad pre atrany (organoprvkové zlúčeniny s väzbami N-> B, N-> Si).
Okrem výmeny a darcu-príjemcu existujetretím mechanizmom je datív (ďalšie názvy sú semipolárne, semipolárne alebo koordinačné spojenie). Donorový atóm daruje pár elektrónov na prázdny orbitál neutrálneho atómu, ktorý na dokončenie vonkajšej úrovne potrebuje dva elektróny. Existuje určitý prechod elektrónovej hustoty z akceptora na donor. V takom prípade sa darca stane kladne nabitým (katión) a akceptor bude nabitým záporne (anión).
Skutočná chemická väzba sa vytvára vďakaväzobná škrupina (prekrytie dvoch spárovaných elektrónov jedného z atómov s vonkajšou voľnou obežnou dráhou druhého) a elektrostatická príťažlivosť vznikajúca medzi katiónom a aniónom. Kovalentný a iónový typ sa teda kombinujú v semipolárnej väzbe. Semipolárna väzba je charakteristická pre d-prvky, ktoré v rôznych zlúčeninách môžu hrať úlohu akceptora aj darcu. Vo väčšine prípadov sa nachádza v komplexných a organických látkach.
Najjednoduchším príkladom je molekula chlóru.Jeden atóm Cl daruje pár elektrónov ďalšiemu atómu chlóru, ktorý má voľný d-orbitál. V tomto prípade je jeden atóm Cl nabitý kladne, druhý negatívne a vzniká medzi nimi elektrostatická príťažlivosť. Vďaka svojej dlhej dĺžke má datívna väzba nižšiu pevnosť v porovnaní s typom kovalentnej výmeny a typu donor-akceptor, ale jej prítomnosť zvyšuje pevnosť molekuly chlóru. Preto sa kl2 silnejší ako F2 (atóm fluóru nemá d-orbitaly, väzba fluór-fluór je iba kovalentnou výmenou).
Molekula oxidu uhoľnatého CO (oxid uhoľnatý)tvorené tromi väzbami C-O. Pretože atómy kyslíka a uhlíka majú na vonkajšej úrovni dva samostatné elektróny, vytvárajú sa medzi nimi dve kovalentné výmenné väzby. Potom má atóm uhlíka prázdny orbitál a atóm O má na vonkajšej úrovni dva páry elektrónov. Preto v molekule oxidu uhoľnatého (II) existuje tretia väzba - semipolárna, vytvorená v dôsledku dvoch valenčných párových elektrónov kyslíka a voľnej obežnej dráhy uhlíka.
Zvážte zložitejší príklad - vytvorenie tohto typu väzby na príklade interakcie dimetyléteru (Н3С-О-СН3) s chloridom hlinitým AlCl3... Atóm kyslíka v dimetyléteri je spojený dvomakovalentné väzby s metylovými skupinami. Potom má na p-podúrovni ešte ďalšie dva elektróny, ktoré dáva akceptorovému atómu (hliník) a stáva sa z neho pozitívny katión. V tomto prípade atóm akceptora získa negatívny náboj (premení sa na anión). Katión a anión navzájom elektrostaticky interagujú.
Mechanizmus tvorby väzby darca-akceptorje dôležitý v ľudskom živote a je rozšírený v chemických zlúčeninách organickej aj anorganickej povahy, čo potvrdzujú aj vyššie diskutované príklady. Amónny alkohol, ktorý obsahuje amónny katión, sa úspešne používa v každodennom živote, medicíne a priemyselnej výrobe hnojív. Hydróniový ión hrá hlavnú úlohu pri rozpúšťaní kyselín vo vode. Oxid uhoľnatý sa používa v priemysle (napríklad pri výrobe hnojív, laserových systémov) a má veľký význam vo fyziologických systémoch ľudského tela.


























