
Uttrycket "ozonskikt" som blev känt på 70-taletbiennium förra seklet, har länge satt på spetsen. Samtidigt förstår få människor riktigt vad detta koncept betyder och hur farligt förstörelsen av ozonskiktet är. Ett ännu större mysterium för många är ozonmolekylens struktur, och i själva verket är den direkt relaterad till problemen med ozonskiktet. Låt oss ta reda på mer om ozon, dess struktur och industriella tillämpningar.
Ozon, eller, som det också kallas, aktivt syre, är en azurblå gas med en skarp metallisk lukt.

Detta ämne kan finnas i alla tre aggregationstillstånd: gasformigt, fast och flytande.
Samtidigt finns ozon i naturen endast i form av en gas som bildar det så kallade ozonskiktet. Det är på grund av dess azurblå färg att himlen verkar blå.
Ozon fick sitt smeknamn "aktivt syre"på grund av dess likhet med syre. Så det viktigaste aktiva kemiska elementet i dessa ämnen är syre (O). Men om syremolekylen innehåller 2 av dess atomer, då ozonmolekylen (formel - O3) består av 3 atomer av detta element.
På grund av denna struktur liknar ozonens egenskaper de som syre men är mer uttalade. I synnerhet som O2, HANDLA OM3 är det starkaste oxidationsmedlet.
Den viktigaste skillnaden mellan dessa "relaterade"ämnen som är viktiga för alla att komma ihåg är följande: ozon kan inte andas, det är giftigt och kan, om det inandas, skada lungorna eller till och med döda en person. Dessutom O3 perfekt för luftrening från giftiga föroreningar. Förresten är det just på grund av detta som det är så lätt att andas efter regn: ozon oxiderar skadliga ämnen som finns i luften och det renas.
Ozonmolekylmodell (bestående av 3 atomersyre) liknar en bild av en vinkel och dess storlek är 117 °. Denna molekyl har inga oparade elektroner, därför är den diamagnetisk. Dessutom har den polaritet, även om den består av atomer av samma element.
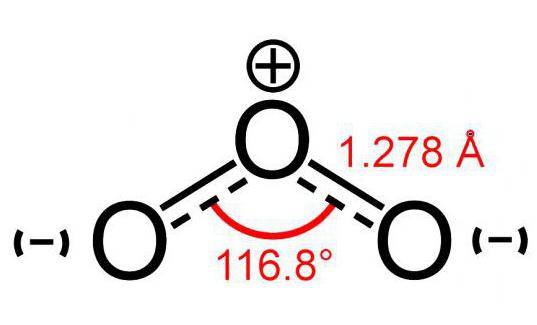
De två atomerna i denna molekyl är fast bundna mellansjälv. Men anslutningen till den tredje är mindre tillförlitlig. Av denna anledning är ozonmolekylen (bilden av modellen kan ses nedan) mycket ömtålig och sönderdelas strax efter bildandet. Som regel för varje reaktion av förfallet av O3 syre frigörs.
På grund av ozons instabilitet är det omöjligt att skaffa och lagra det, liksom att transportera det som andra ämnen. Av denna anledning är dess produktion dyrare än andra ämnen.
Samtidigt är den höga aktiviteten hos O3 gör att detta ämne kan vara det starkaste oxidationsmedlet, kraftfullare än syre och säkrare än klor.
Om ozonmolekylen förstörs och O2, denna reaktion åtföljs alltid av frigöring av energi. Samtidigt, för att den omvända processen ska inträffa (bildandet av O3 från om2) är det nödvändigt att spendera åtminstone det.
I gasform, ozonmolekylensönderdelas vid 70 ° C. Om den höjs till 100 grader eller mer accelererar reaktionen avsevärt. Förekomsten av föroreningar accelererar också nedbrytningsperioden för ozonmolekyler.
Oavsett vilken av de tre stater som ozon finns i behåller den sin blå färg. Ju hårdare ämnet, desto rikare och mörkare blir denna nyans.

Varje ozonmolekyl väger 48 g / mol. Det är tyngre än luft, vilket hjälper till att separera dessa ämnen mellan sig.
Oh3 kan oxidera nästan alla metaller och icke-metaller (förutom guld, iridium och platina).
Detta ämne kan också delta i förbränningsreaktionen, men detta kräver en högre temperatur än för O2.
Ozon kan lösas upp i H2Om och freons. I flytande tillstånd kan den blandas med flytande syre, kväve, metan, argon, koltetraklorid och koldioxid.
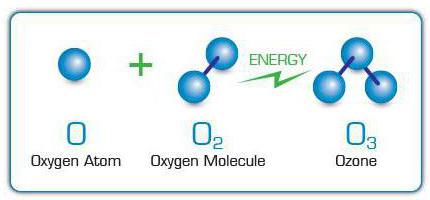
Molekyler O3 bildas genom att fästa fria syreatomer till syremolekyler. De uppträder i sin tur på grund av klyvning av andra O-molekyler2 på grund av påverkan på elektriska urladdningar,ultravioletta strålar, snabba elektroner och andra högenergipartiklar. Av denna anledning kan den specifika lukten av ozon kännas nära gnistrande elektriska apparater eller lampor som avger ultraviolett ljus.

I industriell skala O3 avges med elektriska ozongeneratorer eller ozoniserare. I dessa enheter passeras en högspännings elektrisk ström genom en gasström i vilken O2, vars atomer fungerar som "byggmaterial" för ozon.
Ibland pumpas rent syre eller vanlig luft in i dessa enheter. Kvaliteten på den resulterande ozon beror på den ursprungliga produktens renhet. Så, medicinsk O3, avsedd för behandling av sår, extraheras endast från kemiskt ren O2.
Efter att ha räknat ut hur ozonmolekylen ser ut och hur den bildas är det värt att bekanta sig med ämnets historia.
Den syntetiserades först av holländarnaforskare Martin Van Marum under andra hälften av 1700-talet. Forskaren märkte att efter att ha gett elektriska gnistor genom en behållare med luft, ändrade gasen i den dess egenskaper. Samtidigt förstod Van Marum inte att han hade isolerat molekylerna i ett nytt ämne.
Och här är hans tyska kollega med namnet Scheinbein som försöker sönderdela H2O på N och O2, uppmärksammade utsläpp av ny gas med en skarp lukt. Efter att ha gjort mycket forskning beskrev forskaren ämnet han upptäckte och gav det namnet "ozon" för att hedra det grekiska ordet för "lukt".
Förmågan att döda svampar och bakterier, liksom att minska toxiciteten hos skadliga föreningar, som den öppna substansen hade, lockade många forskares intresse. 17 år efter den officiella öppningen av O3 Werner von Siemens designade den förstaen enhet som låter dig syntetisera ozon i valfri mängd. Och 39 år senare uppfann den lysande Nikola Tesla och patenterade världens första ozongenerator.
Det var den här enheten, redan två år senare, var förstanvänds i Frankrike i dricksvattenreningsverk. Med början av XX-talet. Europa börjar övergå till ozonisering av dricksvatten för dess rening.
Det ryska riket använde först denna teknik 1911, och fem år senare utrustades nästan fyra dussin installationer för rening av dricksvatten med ozon i landet.
Idag ersätter ozonering av vatten gradvis klorering. Således renas 95% av allt dricksvatten i Europa med O3... Denna teknik är också mycket populär i USA. I OSS är det fortfarande under utredning, även om detta förfarande är säkrare och bekvämare, är det dyrare än klorering.
Förutom vattenrening, Oh3 har ett antal andra tillämpningsområden.
På ett avstånd av 15-35 km över jordens yta finns ozonskiktet, eller, som det också kallas, ozonosfären. På denna plats koncentrerad O3 fungerar som ett slags filter för skadlig solstrålning.
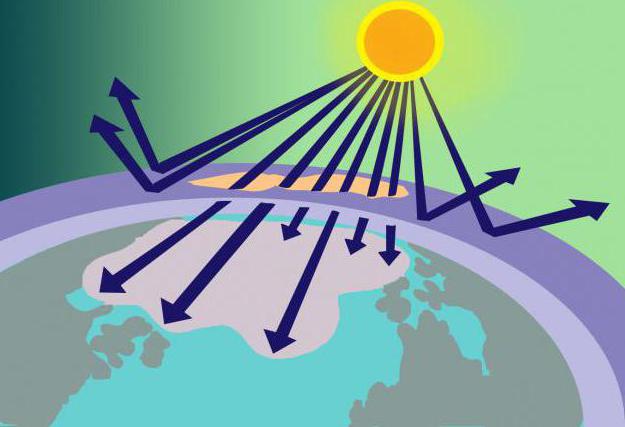
Varifrån kommer denna mängd ämne ifär dess molekyler instabila? Svaret på denna fråga är inte svårt om vi kommer ihåg modellen för ozonmolekylen och metoden för dess bildning. Så syre, som består av två syremolekyler, som kommer in i stratosfären, värms upp där av solens strålar. Denna energi visar sig vara tillräcklig för att dela O2 till atomer från vilka O3... Samtidigt använder ozonskiktet inte bara en del av solenergin utan filtrerar det, absorberar också farligt ultraviolett ljus.
Det sades ovan att ozon löses upp av freoner.Dessa gasformiga ämnen (som används vid tillverkning av deodoranter, brandsläckare och kylskåp), när de väl släppts ut i atmosfären, påverkar ozon och bidrar till dess nedbrytning. Som ett resultat uppträder hål i ozonosfären, genom vilka ofiltrerade solstrålar kommer in på planeten, vilket destruktivt påverkar levande organismer.
Med tanke på egenskaperna och strukturen hos ozonmolekyler kan man komma till slutsatsen att detta ämne, även om det är farligt, är mycket användbart för mänskligheten om det används korrekt.


























