
ฮีเลียมอยู่ในกลุ่มของก๊าซมีตระกูลฮีเลียมเหลวเป็นของเหลวที่เย็นที่สุดในโลก ในสถานะของการรวมตัวนี้มีคุณลักษณะเฉพาะหลายประการเช่น superfluidity และ superconductivity เราจะเรียนรู้เพิ่มเติมเกี่ยวกับคุณสมบัติของมันในภายหลัง
ฮีเลียมเป็นสารที่เรียบง่ายแพร่หลายในจักรวาลในสถานะก๊าซ ในตารางธาตุเป็นวินาทีและอยู่หลังไฮโดรเจนทันที มันเป็นของก๊าซเฉื่อยหรือมีตระกูล
องค์ประกอบถูกกำหนดให้เป็น "เขา"จากภาษากรีกโบราณชื่อของมันหมายถึง "ดวงอาทิตย์" เบื้องต้นสันนิษฐานว่าเป็นโลหะ อย่างไรก็ตามปรากฎว่ามันเป็นก๊าซเชิงเดี่ยว ฮีเลียมเป็นสารเคมีที่เบาที่สุดเป็นอันดับสองไม่มีรสจืดไม่มีสีและไม่มีกลิ่น มีจุดเดือดต่ำสุด
เป็นก๊าซในอุดมคติภายใต้สภาวะปกตินอกจากก๊าซแล้วยังสามารถอยู่ในสถานะของแข็งและของเหลวได้ ความเฉื่อยของมันปรากฏตัวในปฏิสัมพันธ์ที่ไม่ใช้งานกับสารอื่น ๆ แทบไม่ละลายในน้ำ สำหรับวัตถุประสงค์ทางอุตสาหกรรมสกัดจากก๊าซธรรมชาติแยกออกจากสิ่งสกปรกโดยใช้ความเย็นที่แข็งแกร่ง
ก๊าซอาจเป็นอันตรายต่อมนุษย์การเพิ่มความเข้มข้นในอากาศทำให้เลือดขาดออกซิเจนซึ่งในทางการแพทย์เรียกว่าการอดออกซิเจน เมื่อรับประทานเข้าไปในปริมาณมากจะทำให้อาเจียนหมดสติและบางครั้งอาจถึงแก่ชีวิตได้
ก๊าซใด ๆ สามารถเปลี่ยนเป็นของเหลวรวมเงื่อนไขภายใต้เงื่อนไขบางประการ การทำให้เป็นของเหลวมักใช้ในอุตสาหกรรมและในการวิจัยทางวิทยาศาสตร์ สำหรับสารบางชนิดก็เพียงพอที่จะเพิ่มความดัน อื่น ๆ เช่นฮีเลียมจะกลายเป็นของเหลวหลังจากทำความเย็นแล้วเท่านั้น
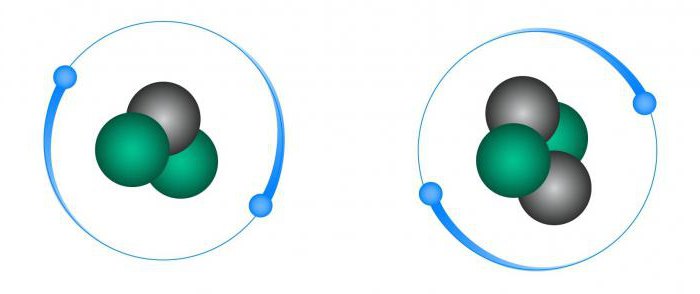
หากอุณหภูมิของก๊าซอยู่เหนือจุดวิกฤตแล้วมันจะไม่ควบแน่นไม่ว่าจะด้วยแรงกดดันใดก็ตาม สำหรับฮีเลียมจุดวิกฤตคืออุณหภูมิ 5, 19 เคลวินสำหรับไอโซโทป 3 เขาคือ 3.35 K

ฮีเลียมเหลวเกือบจะเหมาะอย่างยิ่งของเหลว เป็นลักษณะที่ไม่มีแรงตึงผิวความหนืด หลังจากเปลี่ยนความดันและอุณหภูมิปริมาตรของมันจะยังคงเหมือนเดิม ฮีเลียมเหลวมีความตึงเครียดต่ำมาก สารนี้ไม่มีสีและมีของเหลวสูง
ในสถานะของเหลวฮีเลียมแทบจะไม่สามารถแยกแยะได้เนื่องจากซึ่งหักเหแสงอย่างอ่อน ๆ ภายใต้เงื่อนไขบางประการมันมีคุณสมบัติของของเหลวควอนตัม ด้วยเหตุนี้ที่ความดันปกติจึงไม่ตกผลึกแม้ที่อุณหภูมิ -273.15 เซลเซียส (ศูนย์สัมบูรณ์) สารที่รู้จักอื่น ๆ ทั้งหมดจะแข็งตัวภายใต้เงื่อนไขเหล่านี้
อุณหภูมิของฮีเลียมเหลวที่เริ่มเดือดคือ -268.9 องศาเซลเซียส คุณสมบัติทางกายภาพของไอโซโทปแตกต่างกันไปมาก ดังนั้นฮีเลียม -4 จะเดือดที่อุณหภูมิ 4.215 เค
เป็นของเหลวของ Bose ซึ่งการเปลี่ยนเฟสเป็นลักษณะที่อุณหภูมิ 2.172 เคลวินและต่ำกว่า เฟส He II โดดเด่นด้วย superfluidity และ super thermal conductivity ที่อุณหภูมิต่ำกว่าระยะ He I และ He II เกิดขึ้นพร้อมกันเนื่องจากความเร็วของเสียงสองระดับปรากฏในของเหลว
Helium-3 เป็นของเหลว Fermiเดือดที่ 3.19 เคลวิน ไอโซโทปสามารถบรรลุ superfluidity ได้เฉพาะที่อุณหภูมิต่ำมาก (ไม่กี่มิลลิเคลวิน) เมื่อมีแรงดึงดูดเพียงพอระหว่างอนุภาคของมัน
วิทยาศาสตร์เป็นผลมาจากการศึกษาแนวคิดเรื่อง superfluidityนักวิชาการ SP Kapitza และ LD Landau ในขณะที่ศึกษาคุณสมบัติของฮีเลียมเหลวในปีพ. ศ. 2481 Sergei Kapitsa สังเกตเห็นว่าใกล้ศูนย์สัมบูรณ์ของเหลวจะสูญเสียความหนืดแทนที่จะแข็งตัว
นักวิชาการสรุปว่าหลังจากอุณหภูมิของฮีเลียมลดลงต่ำกว่า 2.172 K สารจะผ่านจากเฟสของสถานะปกติไปยังสารใหม่ที่เรียกว่าฮีเลียม -II ในระยะนี้สารจะผ่านเส้นเลือดฝอยและช่องเปิดแคบ ๆ โดยไม่มีแรงเสียดทานน้อยที่สุด สถานะนี้เรียกว่า "superfluidity"

ในปีพ. ศ. 2484 LD Landau ยังคงศึกษาคุณสมบัติของฮีเลียมเหลวและได้พัฒนาทฤษฎีของ superfluidity เขารับหน้าที่อธิบายโดยวิธีควอนตัมโดยใช้แนวคิดเรื่องสเปกตรัมพลังงานของการกระตุ้น
ธาตุฮีเลียมถูกค้นพบในสเปกตรัมของดวงอาทิตย์ในปีพ. ศ. 2411ปี. วิลเลียมแรมเซย์ถูกค้นพบบนโลกในปีพ. ศ. 2438 หลังจากนั้นได้รับการศึกษาเป็นเวลานานและไม่ได้ใช้ในทรงกลมทางเศรษฐกิจ ในกิจกรรมทางอุตสาหกรรมเริ่มใช้เป็นเชื้อเพลิงสำหรับเรือบินในช่วงสงครามโลกครั้งที่หนึ่ง
ก๊าซถูกนำมาใช้อย่างแข็งขันสำหรับบรรจุภัณฑ์ในอาหารอุตสาหกรรมในการถลุงโลหะ นักธรณีวิทยาใช้เพื่อตรวจจับความผิดพลาดในเปลือกโลก ฮีเลียมเหลวส่วนใหญ่ใช้เป็นสารทำความเย็นที่สามารถรักษาอุณหภูมิที่ต่ำเป็นพิเศษได้ คุณสมบัตินี้จำเป็นสำหรับการวิจัยทางวิทยาศาสตร์
ของเหลวหล่อเย็นใช้ในเครื่องไฟฟ้าที่มีอุณหภูมิต่ำในการสแกนด้วยกล้องจุลทรรศน์แบบอุโมงค์ในการตรวจเอกซเรย์ NMR ทางการแพทย์ในเครื่องเร่งอนุภาคที่มีประจุไฟฟ้า
ฮีเลียมเป็นก๊าซเฉื่อยหรือมีตระกูลที่จัดแสดงกิจกรรมต่ำในการมีปฏิสัมพันธ์กับสารอื่น ๆ ในตารางธาตุนั้นอยู่ในอันดับที่สองโดยให้ไฮโดรเจน โดยธรรมชาติแล้วสารจะอยู่ในสถานะก๊าซ ภายใต้เงื่อนไขบางประการมันสามารถผ่านเข้าสู่สถานะอื่น ๆ ของการรวมตัวได้

คุณสมบัติหลักของฮีเลียมเหลวคือsuperfluidity และไม่สามารถตกผลึกภายใต้ความดันปกติแม้ว่าอุณหภูมิจะถึงศูนย์สัมบูรณ์ก็ตาม คุณสมบัติของไอโซโทปของสสารไม่เหมือนกัน อุณหภูมิวิกฤตสภาวะการเดือดและค่าการหมุนของอนุภาคต่างกัน


























