
70'lerde ünlü olan "ozon tabakası" tabirigg. geçen yüzyılda, uzun zamandır ağrılı olmuştur. Ancak, çok az insan bu kavramın ne anlama geldiğini ve ozon tabakasının tahrip olma tehlikesinin ne olduğunu gerçekten anlamış. Birçokları için daha büyük bir gizem, ozon molekülünün yapısıdır ve yine de ozon tabakasının problemleriyle doğrudan ilişkilidir. Ozon, yapısı ve endüstride kullanımı hakkında daha fazla bilgi edelim.
Ozon veya aktif oksijen olarak da bilindiği gibi keskin metalik kokulu masmavi renkli bir gazdır.

Bu madde üç toplama durumunda da bulunabilir: gaz halinde, katı ve sıvı.
Dahası, doğada, ozon, sözde ozon tabakasını oluşturan sadece gaz şeklinde bulunur. Masmavi renginden dolayı gökyüzünün mavi görünmesi nedeniyle.
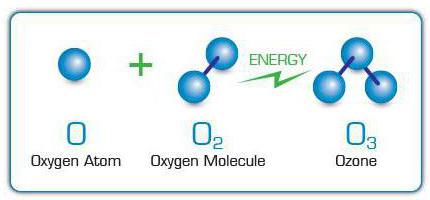
Ozone, "active oxygen" takma adını aldıoksijene benzerliğinden dolayı. Bu yüzden bu maddelerdeki ana aktif kimyasal element oksijendir (O). Bununla birlikte, oksijen molekülü 2 atomunu içeriyorsa, ozon molekülü (formül - O3) bu elementin 3 atomundan oluşur.
Bu yapı nedeniyle, ozonun özellikleri oksijene benzer, ancak daha belirgindir. Özellikle, O gibi2Hakkında3 en güçlü oksitleyici ajandır.
Bu "ilgili" arasındaki en önemli farkHerkesin hatırlayabilmesi için hayati önem taşıyan maddeler şunlardır: ozonu soluyamazsınız, zehirlidir ve solunduğunda akciğerlere zarar verebilir, hatta bir insanı öldürebilir. Dahası, O3 toksik safsızlıklardan havayı temizlemek için mükemmel. Bu arada, tam da bundan dolayı, yağmurdan sonra çok kolay nefes alır: ozon havada bulunan zararlı maddeleri okside eder ve temizlenir.
Ozon molekülü modeli (3 atomdan oluşan)oksijen) bir açının görüntüsü gibi biraz ve büyüklüğü 117 ° 'dir. Bu molekül eşleşmemiş elektronlara sahip değildir, bu nedenle diyagnetiktir. Ek olarak, bir elementin atomlarından oluşmasına rağmen, bir polariteye sahiptir.
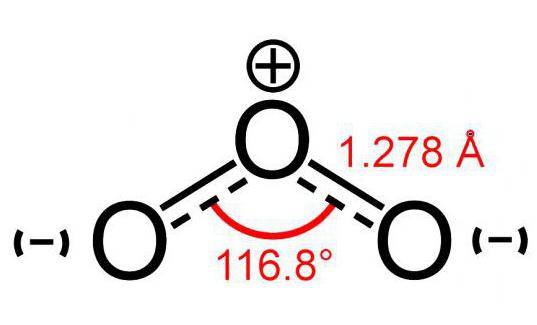
Bu molekülün iki atomu,kendim. Ancak üçüncü ile bağlantı daha az güvenilirdir. Bu nedenle, ozon molekülü (modelin fotoğrafı aşağıda görülebilir) çok kırılgandır ve oluşumdan kısa bir süre sonra parçalanır. Kural olarak, herhangi bir çürüme reaksiyonu O ile3 oksijen serbest.
Ozonun kararsızlığı nedeniyle diğer maddeler gibi taşınmasının yanı sıra hasat edilemez ve saklanamaz. Bu nedenle üretimi diğer maddelere göre daha pahalıdır.
Ayrıca, O moleküllerinin yüksek aktivitesi3 bu maddenin oksijenden daha güçlü ve klordan daha güvenli, en güçlü oksitleyici ajan olmasına izin verir.
Ozon molekülü yok edilirse O salınır.2bu reaksiyona her zaman enerjinin serbest bırakılması eşlik eder. Aynı zamanda, ters işlemin gerçekleşmesi için (O oluşumu)3 Oh'dan2), daha az harcamak gerekmez.
Gaz halinde, ozon molekülü70 ° C sıcaklıkta parçalanır. 100 dereceye veya daha fazla yükseltilirse, reaksiyon önemli ölçüde hızlanır. Safsızlıkların varlığı ozon moleküllerinin bozulma süresini de hızlandırır.
Hangi üç eyalette ozon varsa, mavi kalır. Madde ne kadar sert olursa, bu renk tonu o kadar zengin ve koyu olur.

Her ozon molekülü 48 g / mol ağırlığındadır. Bu maddeleri kendi aralarında ayırmaya yardımcı olan havadan daha ağırdır.
aman3 neredeyse tüm metalleri ve metal olmayanları oksitleyebilir (altın, iridyum ve platin hariç).
Ayrıca, bu madde yanma reaksiyonuna katılabilir, ancak bu O'dan daha yüksek bir sıcaklık gerektirir.2.
Ozon N içinde çözünebilir2Hakkında ve freonlar. Sıvı halde sıvı oksijen, azot, metan, argon, karbon tetraklorür ve karbon dioksit ile karıştırılabilir.
Molecules Hakkında3 oksijen moleküllerine serbest oksijen atomları eklenerek oluşturulur. Sırayla, diğer O moleküllerinin bölünmesinden dolayı ortaya çıkarlar2 elektrik deşarjlarına maruz kalma nedeniyle,ultraviyole ışınları, hızlı elektronlar ve diğer yüksek enerjili parçacıklar. Bu nedenle, ozonun kokusu, köpüklü elektrikli cihazların veya ultraviyole ışık yayan lambaların yakınında hissedilebilir.

Endüstriyel ölçek O3 elektrik ozon jeneratörleri veya ozonizatörler kullanarak yayılır. Bu cihazlarda, yüksek voltajlı bir elektrik akımı O'nun gaz akımından geçirilir.2atomları ozon için “yapı malzemesi” görevi görür.
Bazen bu cihazlara saf oksijen veya normal hava verilir. Ozonun saflığı, başlangıç ürününün saflığına bağlıdır. Yani, tıbbi Oh3sadece kimyasal olarak saf O'dan ekstrakte edilen yaraların tedavisi için tasarlanmıştır2.
Ozon molekülünün nasıl göründüğünü ve nasıl oluştuğunu anladıktan sonra, bu maddenin geçmişi ile tanışmaya değer.
İlk olarak Hollandalılar tarafından sentezlendiXVIII.Yüzyılın ikinci yarısında araştırmacı Martin Van Marum. Bilim adamı, elektrik kıvılcımlarını hava ile bir kaptan geçtikten sonra içindeki gazın özelliklerini değiştirdiğini fark etti. Aynı zamanda Van Marum, yeni bir maddenin moleküllerini izole ettiğini anlamadı.
Ama Alman meslektaşı Scheinbein adıyla elektrik kullanarak ayrışmaya çalışıyor2O ila H ve O2, keskin bir kokuya sahip yeni bir gazın salınmasına dikkat çekti. Çok fazla araştırma yaptıktan sonra, bilim adamı keşfettiği maddeyi tanımladı ve Yunanca “koku” kelimesinin onuruna ona “ozon” adını verdi.
Mantarları ve bakterileri öldürme ve açık bir maddeye sahip olan zararlı bileşiklerin toksisitesini azaltma yeteneği, birçok bilim insanını ilgilendirdi. Oh resmi açılışından 17 yıl sonra3 Werner von Siemens ilk tasarladıozonu herhangi bir miktarda sentezlemenizi sağlayan cihaz. Ve 39 yıl sonra, parlak Nikola Tesla dünyanın ilk ozon jeneratörünü icat etti ve patentini aldı.
Bu cihaz zaten 2 yıl sonra ilk kezFransa'da içme suyu için atıksu arıtma tesislerinde kullanılır. XX yüzyılın başında. Avrupa, saflaştırılması için içme suyunun ozonlanmasına geçmeye başlar.
Rus imparatorluğu ilk olarak 1911'de bu tekniği kullandı ve 5 yıl sonra ülkede ozon kullanarak içme suyunu arıtmak için yaklaşık 4 düzine tesis kuruldu.
Günümüzde suyun ozonlanması yavaş yavaş klorlamanın yerini almaktadır. Yani, Avrupa'daki tüm içme suyunun% 95'i O ile arıtılmaktadır.3. Bu teknik Amerika Birleşik Devletleri'nde de çok popüler. BDT'de hala araştırılmaktadır, çünkü bu prosedür daha güvenli ve daha uygun olmasına rağmen, klorlamadan daha pahalıdır.
Su arıtmanın yanı sıra, Oh3 Bir dizi başka uygulaması var.
Dünya yüzeyinin 15-35 km yukarısında ozon tabakası veya ozonosfer olarak da adlandırılır. Bu yerde konsantre Oh3 zararlı güneş radyasyonu için bir tür filtre görevi görür.
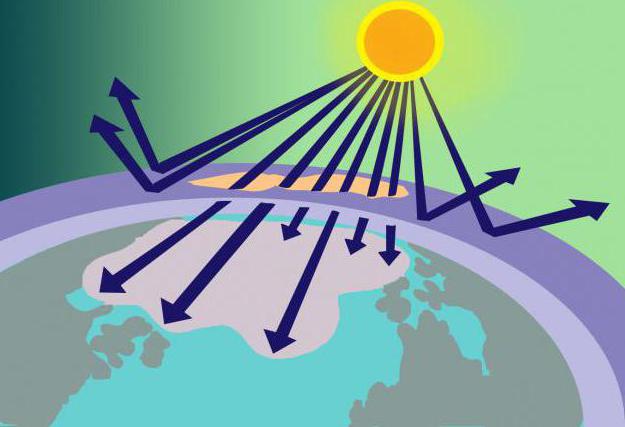
Bu madde miktarı nereden geliyorsamolekülleri kararsız mı? Ozon molekülünün modelini ve oluşum yöntemini hatırlarsak, bu soruya cevap vermek zor değildir. Böylece, stratosfere giren 2 oksijen molekülünden oluşan oksijen orada güneş ışınları tarafından ısıtılır. Bu enerji O'yu bölmek için yeterlidir2 O'nun oluştuğu atomlara3. Aynı zamanda, ozon tabakası sadece güneş enerjisinin bir bölümünü kullanmakla kalmaz, aynı zamanda filtreler, tehlikeli ultraviyole emer.
Yukarıda ozonun freonlar tarafından çözüldüğü söylendi.Bu gazlı maddeler (deodorantlar, yangın söndürücüler ve buzdolaplarının imalatında kullanılır), atmosferde bir kez ozonu etkiler ve ayrışmasına katkıda bulunur. Bunun sonucunda, filtrelenmemiş güneş ışınlarının gezegende düştüğü ozonosferde, canlı organizmaları yıkıcı bir şekilde etkileyen delikler ortaya çıkar.
Ozon moleküllerinin özelliklerini ve yapısını göz önünde bulundurarak, bu maddenin, tehlikeli olmasına rağmen, doğru kullanıldığında insanlık için çok yararlı olduğu sonucuna varabiliriz.


























