
Изразът "озонов слой", който стана известен през 70-те годинидвугодишния миналия век, отдавна е поставен на ръба. В същото време малко хора наистина разбират какво означава това понятие и колко опасно е разрушаването на озоновия слой. Още по-голяма загадка за мнозина е структурата на озоновата молекула и всъщност тя е пряко свързана с проблемите на озоновия слой. Нека разберем повече за озона, неговата структура и промишлени приложения.
Озонът, или, както го наричат още, активен кислород, е лазурен газ с остра метална миризма.

Това вещество може да съществува във всичките три агрегатни състояния: газообразно, твърдо и течно.
В същото време в природата озонът се намира само под формата на газ, образувайки така наречения озонов слой. Именно заради лазурния си цвят небето изглежда синьо.
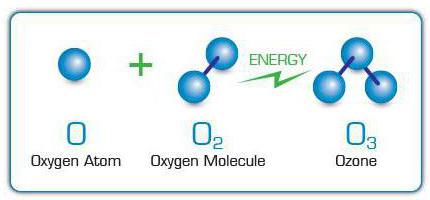
Озонът получи прякора си "активен кислород"поради приликата му с кислорода. Така че основният активен химичен елемент в тези вещества е кислородът (О). Ако обаче кислородната молекула съдържа 2 от своите атоми, тогава озоновата молекула (формула - O3) се състои от 3 атома на този елемент.
Поради тази структура свойствата на озона са подобни на тези на кислорода, но са по-изразени. По-специално, като O2, За3 е най-силният окислител.
Най-важната разлика между тези "свързани"веществата, които са жизненоважни за всеки да запомнят, са следните: озонът не може да се диша, той е токсичен и ако се вдишва, може да увреди белите дробове или дори да убие човек. Нещо повече, O3 идеален за пречистване на въздуха от токсични примеси. Между другото, точно поради това е толкова лесно да се диша след дъжд: озонът окислява вредните вещества, съдържащи се във въздуха, и се пречиства.
Модел на молекулата на озона (съставен от 3 атомакислород) е малко като изображението на ъгъл и неговият размер е 117 °. Тази молекула няма несдвоени електрони, поради което е диамагнитна. Освен това той има полярност, въпреки че се състои от атоми на един и същ елемент.
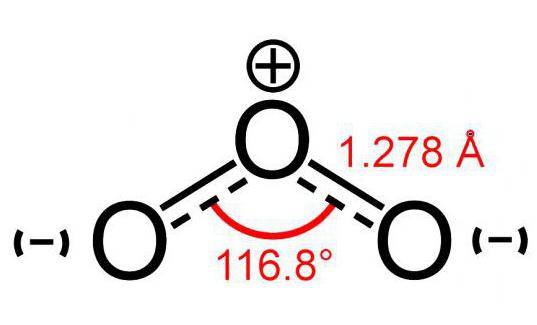
Двата атома на тази молекула са здраво свързани помежду сисебе си. Но връзката с третата е по-малко надеждна. Поради тази причина озоновата молекула (снимката на модела може да се види по-долу) е много крехка и се разлага малко след образуването. Като правило, за всяка реакция на разпадане на O3 освобождава се кислород.
Поради нестабилността на озона е невъзможно да се набави и съхрани, както и да се транспортира като други вещества. Поради тази причина производството му е по-скъпо от други вещества.
Освен това, високата активност на O3 позволява това вещество да бъде най-силният окислител, по-мощен от кислорода и по-безопасен от хлора.
Ако молекулата на озона е унищожена и O2, тази реакция винаги е придружена от освобождаването на енергия. В същото време, за да настъпи обратният процес (образуването на O3 от около2), трябва да го похарчите поне.
В газообразно състояние молекулата на озонаразлага се при 70 ° C. Ако се увеличи до 100 градуса или повече, реакцията ще се ускори значително. Наличието на примеси също ускорява периода на разпадане на озоновите молекули.
Каквото и да е от трите състояния на озона, той запазва синия си цвят. Колкото по-твърдо е веществото, толкова по-наситен и тъмен е този нюанс.

Всяка молекула озон тежи 48 g / mol. Той е по-тежък от въздуха, което помага да се разделят тези вещества помежду си.
ох3 е способен да окислява почти всички метали и неметали (с изключение на злато, иридий и платина).
Също така, това вещество може да участва в реакцията на горене, но това изисква по-висока температура, отколкото за О2.
Озонът е в състояние да се разтвори в Н2За и фреони. В течно състояние може да се смесва с течен кислород, азот, метан, аргон, въглероден тетрахлорид и въглероден диоксид.
Молекули O3 се образуват чрез прикрепване на свободни кислородни атоми към кислородните молекули. Те от своя страна се появяват поради разцепването на други О молекули2 поради въздействието върху тях на електрически разряди,ултравиолетови лъчи, бързи електрони и други високоенергийни частици. Поради тази причина специфичната миризма на озон може да се усети близо до искрящи електрически уреди или лампи, излъчващи ултравиолетова светлина.

В промишлен мащаб O3 излъчвани с помощта на електрически генератори на озон или озонатори. В тези устройства електрически ток с високо напрежение се предава през газов поток, в който O2, чиито атоми служат като „строителен материал“ за озона.
Понякога в тези устройства се вкарва чист кислород или обикновен въздух. Качеството на получения озон зависи от чистотата на първоначалния продукт. И така, медицински O3, предназначен за лечение на рани, се извлича само от химически чист О2.
След като разбрахме как изглежда и как се образува озоновата молекула, струва си да се запознаем с историята на това вещество.
За първи път е синтезиран от холандцитеизследователят Мартин Ван Марум през втората половина на 18 век. Ученият забелязал, че след преминаване на електрически искри през съд с въздух, газът в него е променил свойствата си. В същото време Ван Марум не разбра, че е изолирал молекулите на ново вещество.
И ето го немският колега на име Шейнбайн, който се опитва да разложи H2O на N и O2, обърна внимание на отделянето на нов газ с остра миризма. След като проведе много изследвания, ученият описа описаното от него вещество и му даде името „озон“ в чест на гръцката дума за „миризма“.
Способността да убива гъбички и бактерии, както и да намалява токсичността на вредните съединения, която притежаваше отвореното вещество, интересува много учени. 17 години след официалното откриване на O3 Вернер фон Сименс проектира първияустройство, което ви позволява да синтезирате озон във всяко количество. И 39 години по-късно, брилянтният Никола Тесла изобретил и патентовал първия в света генератор на озон.
Именно това устройство след 2 години беше първоизползвани във Франция в пречиствателни станции за питейна вода. С началото на XX век. Европа започва да преминава към озониране на питейната вода за нейното пречистване.
Руската империя за първи път използва тази техника през 1911 г. и след 5 години в страната са оборудвани почти 4 дузини инсталации за пречистване на питейна вода с помощта на озон.
Днес озонирането на водата постепенно замества хлорирането. По този начин 95% от цялата питейна вода в Европа се пречиства с O3... Тази техника е много популярна и в САЩ. В ОНД тя все още се проучва, тъй като, въпреки че тази процедура е по-безопасна и по-удобна, тя е по-скъпа от хлорирането.
Освен пречистването на водата, О3 има редица други приложения.
На разстояние 15-35 км над повърхността на Земята се намира озоновият слой или, както го наричат още, озоносферата. На това място се концентрира O3 служи като вид филтър за вредно слънчево лъчение.
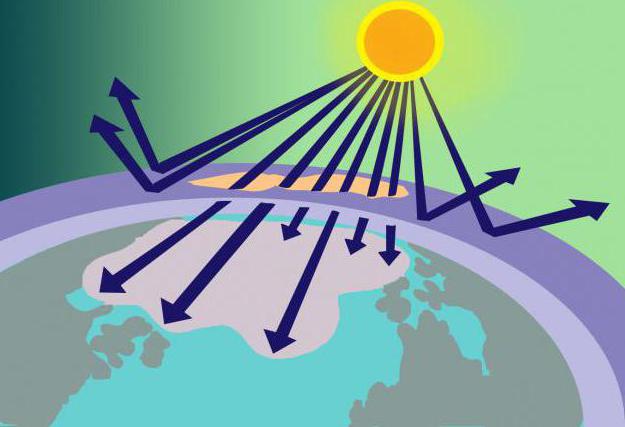
Откъде идва такова количество вещество, аконеговите молекули са нестабилни? Отговорът на този въпрос не е труден, ако си припомним модела на озоновата молекула и начина на нейното образуване. И така, кислородът, състоящ се от 2 молекули кислород, попадайки в стратосферата, се нагрява там от слънчевите лъчи. Тази енергия е достатъчна за разделяне на O2 в атомите, от които O3... В същото време озоновият слой не само използва част от слънчевата енергия, но и я филтрира, абсорбира опасната ултравиолетова светлина.
По-горе беше казано, че озонът се разтваря от фреоните.Тези газообразни вещества (използвани при производството на дезодоранти, пожарогасители и хладилници), веднъж изпуснати в атмосферата, въздействат на озона и допринасят за неговото разлагане. В резултат на това в озоносферата се появяват дупки, през които на филтъра навлизат нефилтрирани слънчеви лъчи, които разрушително въздействат върху живите организми.
След разглеждане на характеристиките и структурата на молекулите на озона, може да се стигне до извода, че това вещество, макар и опасно, е много полезно за човечеството, ако се използва правилно.


























