
Vlastnosti struktury acetylenu ovlivňují jeho vlastnosti, výrobu a použití. Symbol složení látky - C2H2 - Toto je jeho nejjednodušší a hrubší vzorec.Acetylen je tvořen dvěma atomy uhlíku, mezi nimiž vzniká trojná vazba. Jeho přítomnost odráží různé typy vzorců a modelů molekuly ethinu, což umožňuje porozumět problému vlivu struktury na vlastnosti látky.
Uhlovodíky alkány nebo acetylen jsouacyklický, nenasycený. Řetězec atomů uhlíku není uzavřen, obsahuje jednoduché a vícenásobné vazby. Složení alkynů odráží sloučeninu vzorce CPaneX2n - 2. V molekulách látek této třídy je přítomnajednu nebo více trojných vazeb. Acetylenové sloučeniny jsou nenasycené. To znamená, že pouze jedna uhlíková valence je způsobena vodíkem. Zbývající tři vazby se používají při interakci s jinými atomy uhlíku.
První - a nejslavnější zástupcealkiny - acetylen nebo ethin. Trojité jméno látky pochází z latinského slova "acetum" - "ocet" a řeckého - "hyle" - "tree". Předchůdce homologní série byl objeven v roce 1836 v chemických experimentech, později byla látka syntetizována z uhlí a vodíku E. Devi a M. Berthelot (1862). Při normální teplotě a normálním atmosférickém tlaku je acetylen v plynném stavu. Je to bezbarvý plyn, bez zápachu, špatně rozpustný ve vodě. Etin se snadno rozpouští v ethanolu a acetonu.

Aetin je nejjednodušší člen jeho homologní řady, jeho složení a struktura odráží vzorce:
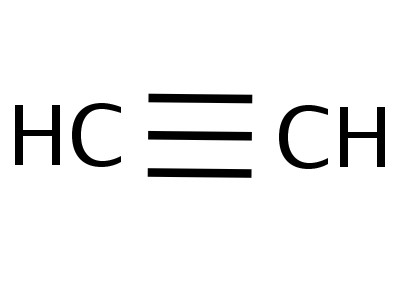
Формулы, показывающие распределение электронов, sloužil jako základ pro vytvoření modelů atomových orbitalů, prostorových molekul (stereochemických). Již koncem 18. století se rozšířily kuličkové ložiskové modely - například kuličky různých barev a velikostí, které označují uhlík a vodík, které tvoří acetylen. Strukturní vzorec molekuly je reprezentován ve formě prutů, symbolizujících chemické vazby a jejich počet na každém atomu.
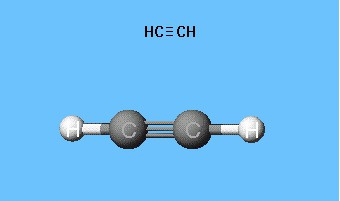
Model acetylenového válečkového reproduktoru reprodukujevazebné úhly rovnající se 180 °, ale interkleární vzdálenosti v molekule se odrážejí přibližně. Dutiny mezi kuličkami nevytvářejí představu o naplnění prostoru atomů s elektronovou hustotou. Nevýhoda je vyloučena v modelech Dreyding, které označují jádra atomů nikoliv koulemi, ale body vzájemného připevnění tyčí. Moderní volumetrické modely poskytují živější představu atomových a molekulárních orbitálů.
Uhlík v excitovaném stavu obsahuje tři p orbitály a jedno s nepárovými elektrony. Při tvorbě methanu (CH4) jsou zapojeni do vytváření stejné hodnotyvazby s atomy vodíku. Známý americký badatel L. Pauling vyvinul teorii hybridního stavu atomových orbitálů (AO). Vysvětlením chování uhlíku v chemických reakcích je přizpůsobení AO tvaru a energii, vytváření nových mraků. Hybridní orbitaly poskytují silnější spojení, vzorec se stává stabilnějším.
Atomy uhlíku v molekule acetylenu, na rozdíl od tohometan prochází sp-hybridizací. Tvar a energetické směšování s- a p-elektronů. Dvě sp orbity se objevují pod úhlem 180 °, nasměrované na protilehlé straně jádra.

V acetylenu hybridní uhlíkové elektronové mrakypodílet se na tvorbě σ-vazeb se stejnými sousedními atomy a vodíkem v párech C-H. Dvě nehybridní p-orbitály, které jsou navzájem kolmé, zůstávají. V molekule ethinu se podílejí na tvorbě dvou π-vazeb. Spolu s σ vzniká trojná vazba, která se odráží strukturním vzorcem. Acetylen se liší od ethanu a ethylenu vzdáleností mezi atomy. Trojná vazba je kratší než dvojnásobná, ale má velkou energetickou rezervu, je odolnější. Maximální hustota σ- a π-vazeb je umístěna v kolmých oblastech, což vede k vytvoření válcového elektronového oblaku.
Молекула этина имеет линейную форму, что удачно odráží chemický vzorec acetylen-H-C = C - H. Uhlíkové a vodíkové atomy jsou podél jedné přímky, mezi nimi vzniknou 3 σ- a 2 π-vazby. Volný pohyb, rotace podél osy C - C je nemožné, což brání přítomnost vícenásobných vazeb. Jiné funkce trojitých vazeb:
Pro porovnání: v molekulách ethanu a ethylenu je délka jednoznačných a dvojitých chemických vazeb 1,54 a 1,34 nm, C-C energie prasknutí je 348 kJ / mol, C = C je 614 kJ / mol.

Acetylen je nejjednodušší zástupce alkynů, jejichž molekuly mají také trojnou vazbu. Propine CH3C = CH je homolog acetylenu. Vzorec třetí reprezentativní alkyn-butin-1-CH3CH2С≡СН. Acetylen je triviální název ethinu. Systémová nomenklatura alkynů se řídí pravidly IUPAC

Etin a propyn nemají triple izomerypřipojení, se objeví, začíná s butine. Uhlíkový skelet má izomery v pentinu a následující homology. Vzhledem k trojné vazbě se prostorová izomerizace acetylenových uhlovodíků nezdá.
První čtyři homology ethinu jsou plyny, které jsou špatně rozpustné ve vodě. Uhlovodíky acetylenu C5 - C15 - kapaliny. Pevné látky jsou homology ethinu, přičemž se vychází z uhlovodíku C17. Chemická povaha alkénů prožívávýznamný efekt trojitých vazeb. Uhlovodíky tohoto typu jsou aktivnější než ethylen, připojují různé částice. Tato vlastnost je založena na rozšířeném používání ethinu v průmyslu a technologii. Při spalování acetylenu vzniká velké množství tepla, které se používá při řezání plynu a svařování kovů.


























