
Amoniak - vodík nitrid - jedna z nejdůležitějších sloučenin dusíku a vodíku. Jedná se o plyn bez barvy, ale s ostrým zápachem. Chemické složení odpovídá vzorci amoniak - NH3. Zvýšení tlaku nebo snížení teplotylátka vede k její transformaci na bezbarvou kapalinu. Plynný amoniak a jeho roztoky jsou široce používány v průmyslu a zemědělství. V medicíně se používá 10% hydroxidu amonného - amoniaku.
Molekula nitridu vodíku ve tvaru se podobápyramid, na jehož bázi je dusík, spojený se třemi atomy vodíku. N-H vazby jsou silně polarizovány. Dusík přitahuje silněji vazebný elektronový pár. Proto se záporný náboj akumuluje na atomech N, pozitivní náboj se koncentruje na vodík. Model molekuly, elektronický a strukturální vzorec amoniaku, dává představu o tomto procesu.

Nitrid vodíku se velmi dobře rozpouští ve vodě(700: 1 při 20 ° C). Přítomnost prakticky volných protonů vede k tvorbě četných vodíkových "mostů", které spojují molekuly dohromady. Vlastnosti struktury a chemické vazby také vedou k tomu, že amoniak se snadno zkapalňuje zvýšením tlaku nebo snížením teploty (-33 ° C).

Termín "amoniak" byl zaveden do vědeckého použití v roce 20081801 na návrh ruského chemiků Ya. Zakharova, ale podstata lidstva je známá od dávných dob. Plyn se špičatým zápachem se uvolňuje při rozkladu produktů s vitální aktivitou, mnoha organických sloučenin, například bílkovin a močoviny, během rozkladu amonných solí. Historici chemie věří, že látka byla pojmenována podle starobylého egyptského boha Amuna. V severní Africe je oáza Siwa (Ammon). Obklopené libyjskou pouští, jsou zříceniny starobylého města a chrámu, vedle něhož jsou uloženy chlorid amonný. Tato látka v Evropě se nazývala "Ammonova sůl". Tam je tradice, že obyvatelé oázy Siwa čichal sůl v chrámu.
Anglický fyzik a chemik R.Boyle v experimentech spálil hnoje a pozorována tvorba bílého kouře z vaty namočeným v kyselině chlorovodíkové a získaná přivádí do proudu plynu. V roce 1774, další britská lékárna J. Priestley zahřeje chloridu amonného s hašeného vápna a plynné přiděleny. Priestley tzv sloučenina „alkalický vzduch“, protože jeho řešení ukázaly slabé báze vlastnosti. Přijaté vysvětlení zkušenosti Boyle, přičemž amoniak se nechá reagovat s kyselinou chlorovodíkovou. Bílá pevná látka molekul chloridu amonného dochází při kontaktu reakčních složek ve vzduchu.

Chemický vzorec amoniaku byl stanoven v roce 20041875 Francouze K. Bertolle, který provedl experiment na rozložení hmoty do kompozitních složek při působení elektrického výboje. Dosud byly experimenty s Priestleym, Boylem a Bertholletem reprodukovány v laboratořích pro výrobu nitridu vodíku a chloridu amonného. Průmyslová metoda byla vyvinuta v roce 1901 A. Le Chatelierem, který obdržel patent na způsob syntézy hmoty z dusíku a vodíku.

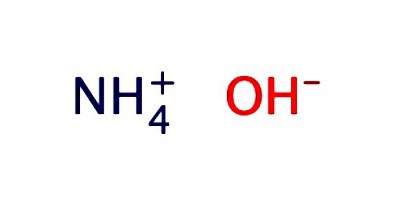
Vodný roztok amoniaku se obvykle zaznamenává jako hydroxid-NH4OH. Vykazuje vlastnosti slabé alkálie:
Rovnováha při reakci amoniaku svoda je přemístěna směrem k surovinám. Předhřátý nitrid vodíku dobře spaluje v kyslíku. Oxidace dusíku nastává u diatomických molekul jednoduché hmoty N2. Redukční vlastnosti amoniaku se také projevují při reakci s oxidem měďnatým.

Nitrid vodíku se používá při výrobě solíkyselina amonná a kyselina dusičná - jeden z nejdůležitějších produktů chemického průmyslu. Amoniak slouží jako surovina pro výrobu sody (podle metody dusičnanů). Obsah nitridu vodíku v průmyslovém koncentrovaném roztoku dosahuje 25%. V zemědělství se používá vodný roztok amoniaku. Vzorec tekutých hnojiv - NH4OH.Látka se přímo používá jako vrchní obvaz. Dalšími způsoby obohacování půdy dusíkem jsou použití amonných solí: dusičnany, chloridy, fosforečnany. V průmyslových podmínkách a zemědělských objektech se nedoporučuje skladovat minerální hnojiva obsahující amonné soli spolu s alkálií. Pokud je porušena celistvost obalu, mohou látky reagovat navzájem, aby vytvořily čpavek a uvolnili ho do ovzduší. Tato toxická sloučenina nepříznivě ovlivňuje dýchací systém, centrální nervový systém člověka. Směs amoniaku a vzduchu je výbušná.


























