
Der pH-Wert ist wichtig.eine Rolle für viele chemische und biologische Umwandlungen, sowohl in Laboratorien und bei der Arbeit als auch in lebenden Organismen und in der Umwelt. Die Menge an Wasserstoffionen beeinflusst nicht nur das Ergebnis einer Reaktion, sondern auch die Möglichkeit ihres Auftretens. Zur Aufrechterhaltung eines bestimmten pH-Wertes mit Pufferlösungen. Ihre Aufgabe ist es, dieses Niveau aufrechtzuerhalten, wenn Sie Lösungen verdünnen oder Säuren und Laugen hinzufügen.
Der pH-Wert des Wassers ist eines der AnzeichenWasserqualität für verschiedene Zwecke. In der Natur hängen die Entwicklung der Pflanzen und die Aggressivität der Umgebung für Metall- und Betonkonstruktionen davon ab. Es ist zu beachten, dass der pH-Wert die Toxizität von Schadstoffen für in Flüssen, Seen und Teichen lebende Organismen verändert.

Dieser Parameter kennzeichnet den Ionengehalt Η+ in Lösungen. Es ist pH angegeben. Mathematisch entspricht der Wasserstoffindex dem inversen dezimalen Logarithmus der Konzentration+ (VonH +mol / l): pΗ = −lgCH +. Die Anzahl der H + -Ionen in Wasser wird durch die Dissoziation von H-Molekülen bestimmt2Oh, was passiert nach dem Ausdruck: H2Über <-> N+ + ER-.
Obwohl es nicht üblich ist, Wasser auf Elektrolyte zu beziehen, ist es ein wenig dissoziierendes Mittel. Für sie können Sie die Dissoziationskonstante schreiben: Kd= (CH +· MitOH-) / CH2O. Bei t = 22 ° C beträgt der Wert 1,8 bis 10-16.
Diese Zahl ist so klein, dass die Ionen Η sind+ und er- im Wasser könnte vernachlässigt werden. In der Chemie von Lösungen ist der pH-Wert jedoch anwendbar, um eine pH-Skala zu erstellen. Betrachten Sie seine Bedeutung.
Es kann verwendet werden, um den Säuregehalt einer Lösung zu quantifizieren.
| PΗ Wert | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ich | 10 | 11 | 12 | 13 | 14 |
| Qualität der Umwelt | sauer | neutral | alkalisch |
Der pH-Wert des Mediums ist leicht zu berechnen. Es ist nur erforderlich, die Konzentration der Wasserstoffkationen zu kennen und die Formel zu verwenden:n + = 10HerrDabei ist n der pH-Wert mit entgegengesetztem Vorzeichen. Zum Beispiel die Konzentration von H+ in Lösung ist CH + = 10–5 Mol / l Das heißt, n = –5 und pH = 5.

Alles in der menschlichen Umgebung hat seinebestimmte pH-Werte. Dies hilft verschiedenen Körpersystemen, ihre Aufgaben leichter zu bewältigen. Bekanntlich beträgt der pH-Wert für reines neutrales Wasser 7. Die menschliche Haut reagiert jedoch leicht sauer. Ihr pH-Wert beträgt 5,5. Teilweise beeinflusst diese Tatsache das Erscheinungsbild trockener Haut mit häufigem Kontakt mit Wasser. Nachfolgend sind die pH-Werte einiger Substanzen angegeben.
| Substanz | pΗ |
| Batterie-Elektrolyt | <1,0 |
| Magensaft | 1,0-2,0 |
| Zitronensaft | 2,0 |
| Tischessig | 2,4 |
| Cola | 3,0 |
| Apfelsaft | 3,0 |
| Kaffee | 5,0 |
| Shampoo | 5,5 |
| Schwarzer Tee | 5,5 |
| Männerhaut | 5,5 |
| Saurer Regen | <5,6 |
| Speichel | 6,5 |
| Milch | 6,7 |
| Wasser | 7,0 |
| Das Blut | 7,36 |
| Meerwasser | 8,0 |
| Feste Seife | 9,5 |
| Bleichmittel (Bleichmittel) | 12,5 |
Водные растворы, как уже указано выше, могут neutral, sauer oder alkalisch reagieren. Die Tatsache, dass die Acidität der Lösung auf die Anwesenheit von H + -Ionen und die Alkalität auf OH– -Ionen zurückzuführen ist, bedeutet nicht, dass sie keine anderen enthalten. In sauren Medien kann ein Überschuss an Wasserstoffionen und in alkalischen Umgebungen ein Überschuss an Hydroxidionen nachgewiesen werden.
In neutralen Lösungen beträgt der Wasserstoffexponent 7. Dies bedeutet, dass die Konzentration der Kationen N+ in ihnen ist gleich 10–7 mol / l, aber der Gehalt an Hydroxidanionen beträgt ebenfalls 10–7 mol / l. Mit anderen Worten, in neutralen Lösungen gibt es keinen Überschuss an Η + - oder ОΗ- -Ionen.
Warum kann der pH-Wert zwischen 1 und 14 liegen? Um diese Frage zu beantworten, lohnt es sich, auf den Ausdruck der Dissoziationskonstante zurückzukommen. Durch Konvertieren können wir K schreibend· MitH2O= CH +· MitOH-. Der Wert von Cd ist bekannt und die Konzentration der Wassermoleküle kann leicht berechnet werden. Behandlung von Wasser als Lösung von H2Oh in N2Oh, Sie können seine molare Konzentration herausfinden, die den Anteil ausmacht: 18 g N2O - 1 Mol, 1000 g N2Oh x mol. Daher ist x = 1000/18 = 55,6 mol / l. Diese Konstante wird mit K bezeichnetin und nannte das ionische Produkt von Wasser.
Als nächstes multiplizieren Sie den Wert von Kd durch den gefundenen Wert: 55,6 · 1,8 · 10–16= CΗ +· MitΗ–; 10–14 = CΗ +· MitΗ–. Das heißt, wir können schreiben: Kin= CΗ +· MitΗ– = 10–14.
Dieser Wert ließ den Schluss zu, dass pΗ + pOΗ = 14 ist, was die Antwort auf die obige Frage ist.
Alle starken Säuren im Wasser dissoziieren irreversibel. Salzsäure zerfällt also vollständig in Kationen ations+ und Chloridanionen Cl-: ΗCl = Η++ Cl-. Wenn 1ˑ10 zu 1 Liter Wasser gegeben wird-2 mol = Cl, dann die Konzentration der Ionen =+ wird auch gleich 1 sein.10-2 mol. Das heißt, für eine solche Lösung beträgt der Wasserstoffindex 2.
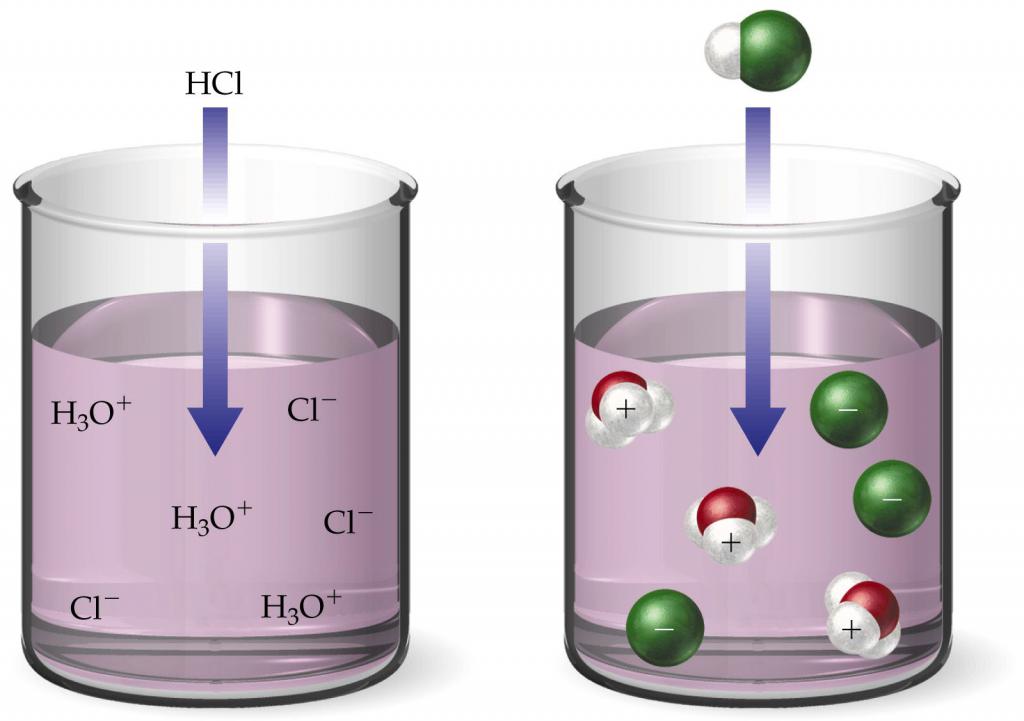
Schwache Säuren dissoziieren reversibel, das heißt,wie im Fall von Wasser wird ein Teil der entgegengesetzt geladenen Ionen wieder zu Säuremolekülen vereinigt. Beispielsweise zerfällt Kohlensäure in die folgenden Ionen::2Mit3 <-> Η++ ΗCO3-. Nicht nur dissoziieren nicht alle Moleküle, sondern zerfallen auch wieder zu einem Ganzen. Um den Wasserstoffindex von Säuren zu ermitteln, wird daher die Dissoziationskonstante verwendet.
Zusätzlich kann die Stärke der Säure indirekt durch den pH-Wert der Lösung abgeschätzt werden: Je größer sie ist, desto niedriger ist der pΗ-Wert.
Wenn die Basen in Wasser gelöst sind, beginnen sieDissoziation mit dem Auftreten von Hydroxidanionen. Sie interagieren mit H + -Ionen, die in neutralem sauberem Wasser vorhanden sind. Dies führt zu einer Abnahme ihrer Konzentration, dh zu einer Erhöhung des pH-Wertes.
Zum Beispiel: NaOΗ = Na++ OΗ-; Η++ OΗ-= Η2O.
In einer Lösung von Natriumhydroxid mit einer Konzentration von 1ˑ10-2 mol / l erscheint 1ˑ10-2 mol / l Hydroxidanionen. Kationenkonzentration Η+ in einer solchen Lösung wird gleich 1ˑ10 sein-12 mol / l und pΗ hat einen Wert von 12.
In allen Basislösungen ist die Menge der Kationen N+ immer weniger als 1ˑ10-7 mol / l und der Wasserstoffindex ist größer als 7.

Eine der einfachsten Möglichkeiten zur AnnäherungBestimmen Sie den pΗ der Lösung - verwenden Sie die Streifen des Universalindikators. Durch Vergleich mit der Indikatorskala ihrer Farbe, die nach dem Eintauchen in die Arbeitslösung auftritt, ist es möglich, die Konzentration von Ionen Η abzuschätzen+. Ein Universalindikator ist eine Mischung aus mehreren Substanzen, die ihre Farbe nacheinander von rot nach violett (wie bei einem Regenbogen) mit abnehmendem Säuregehalt ändert.
Die Hauptnachteile dieser Methode sind die Unmöglichkeit, den Wasserstoffindex in gefärbten oder trüben Lösungen zu bestimmen, sowie nur eine grobe Abschätzung der Ionenkonzentration Η+ in Lösung.
Zur noch gröberen Bestimmung des pH-Wertesverschiedene Indikatoren anwenden. Die am häufigsten verwendeten Lackmus, Methylorange, Phenolphthalein und andere. Anhand der Farbänderung können Sie nur feststellen, ob die Testzusammensetzung sauer, alkalisch oder neutral ist.
| Anzeige | p <7 | pΗ = 7 | p> 7 |
| Lackmus | rot | lila | blau |
| Phenolphthalein | farblos | farblos | Himbeere |
| Methylorange | pink | orange | gelb |
Deutlich genauere Ionenkonzentration Η+und daher kann pΗ der Lösung gefunden werdenmit einem pH-Meter. Diese Analysemethode wird als potentiometrisch bezeichnet. Es basiert auf der Messung des Elektrodenpotentials und der Bestimmung des Verhältnisses zwischen seinem Wert und der Konzentration der Komponente in der Testlösung. Das Elektrodenpotential entsteht aufgrund des elektrochemischen Prozesses an der Grenzfläche zwischen Metall und Lösung.

Zu messeneine galvanische Zelle aus zwei Halbzellen mit Elektroden, deren Potential vorab bekannt ist. Dann messen Sie die EMF. Am häufigsten wird die Bestimmung des Wasserstoffindex in wässrigen Lösungen unter Verwendung von Silberchlorid- und Glaselektroden durchgeführt. Die erste davon ist eine Referenzelektrode. Der Wert des Potentials der Sekunde hängt von der Konzentration der Ionen Η ab+ in Lösung.
Auch der pH-Wert in den Laboratorien wird bestimmtkolorimetrisch. Diese Methode basiert auf der Fähigkeit von Zweifarbenindikatoren, ihre Farbe oder Farbintensität in Abhängigkeit vom Gehalt an Wasserstoffkationen zu ändern. Die Farbe, die in der Lösung erscheint, wird mit einer Standardskala verglichen, die auf Daten von Lösungen mit einem bekannten pH-Wert basiert.
Sie sind wie folgt:
1. Zur Herstellung von Produkten mit gewünschten Eigenschaften. Während des Herstellungsprozesses kann eine Abweichung vonDer technologische pH-Wert kann Störungen verursachen, die zu einer Änderung der Produkteigenschaften führen. Solche Indikatoren können Geschmack oder Aussehen sein.
2. Um die Kosten zu senken. In einigen Industrien hängt die Ausbeute des Produkts direkt oder indirekt vom pH-Wert des Reaktionsmediums ab. Dementsprechend sind die Kosten umso geringer, je höher die Ausbeute des Reaktionsprodukts ist.
3. Zum Schutz der Arbeit oder der Umwelt. Da viele Verbindungen ihre schädlichen Eigenschaften erst bei einem bestimmten pH-Wert zeigen, ist es sehr wichtig, dessen Wert zu kontrollieren.
4. Um Produktstandards zu erfüllen. In viele regulatorische Dokumente standardisierenIn Bezug auf die Qualität des Produkts, des Produkts, der Medizin usw. gibt es eine Liste von Indikatoren, denen sie entsprechen müssen. Eines davon ist der pH-Wert. So trägt seine Definition zum Teil zum Schutz der Bevölkerung vor Schadstoffen bei.
5. Zum Schutz der Ausrüstung. Die meisten produktionsanlagen,das mit Chemikalien in Kontakt kommt, ist korrosionsanfällig. Die Geschwindigkeit seiner Entwicklung hängt stark von den pH-Werten ab. Mit anderen Worten, die pH-Messung ist wichtig, um Produktionsanlagen vor unnötigen Schäden zu schützen.

6. Für Forschungszwecke. Der pH-Wert ist wichtig für die Untersuchung verschiedener biochemischer Prozesse. Es wird auch für medizinische Zwecke gemessen, um eine bestimmte Diagnose zu bestätigen.
Zur berechneten Bestimmung des pH-Wertes der Lösung Angaben zur molaren Konzentration der Kationen Η+ oder ОΗ-Anion. Wenn sie bekannt sind, können Sie sofort eine der folgenden Formeln verwenden:
Die Konzentration eines bestimmten Ions in mol / l in einer Elektrolytlösung kann leicht durch die folgende Gleichung ermittelt werden:
Mitm ion = CmˑΑˑ⋅n, wo:
Cm ion und C.m - molare Konzentrationen von Ionen bzw. Elektrolyt (mol / l).
α ist der Dissoziationsgrad.
n ist die Anzahl der Ionen der betreffenden Spezies, die beim Zerfall nur eines Elektrolytmoleküls gebildet werden.
Der Dissoziationsgrad schwacher Elektrolyte kann durch das Ostwald-Verdünnungsgesetz bestimmt werden: α = √ (K.d/ S.m).
1. Es ist erforderlich, den pH-Wert einer 0,001 N NaOH-Lösung zu berechnen.
Lösung: Da Natriumhydroxid ein starker Elektrolyt ist, ist seine Dissoziation in einer wässrigen Lösung irreversibel. Es geht nach der Gleichung: NaOΗ → Na + OΗ.
Wir verwenden die Formel C.m ion = CmˑΑˑn. Wir nehmen an, dass der Dissoziationsgrad gleich 1 ist. Wenn ein NaOH-Molekül zerstört wird, wird ein OH-Ion gebildet, was n = 1 bedeutet. Mitm Durch den Zustand des Problems ist es bekannt und gleich 0,001 oder 10-3. Von hier nachOH= 10-3ˑ1ˑ1 = 10-3.
Die Konzentration der Ionen Η + kann aus der Beziehung K bestimmt werdenin= CΗ +· MitΗ– = 10–14. Wenn wir die Formel transformieren, erhalten wir C.H += K.in/ S.Η–= 10–14/ 10-3= 10–11. Als nächstes können wir den Wasserstoffindex berechnen: pΗ = -lg10-11= 11.
Antwort: pH = 11.

2. Es ist erforderlich, [Η zu berechnen+] und [OH-], wenn in einer gegebenen Lösung pH = 4,3.
Lösung: Es ist am einfachsten, zuerst die Konzentration der Wasserstoffkationen zu ermitteln: [Η+u = 10-rΗ = 10-4,3 = 5 · 10-5 mol / l.
Die Konzentration an Hydroxidanionen ergibt sich zweckmäßigerweise aus dem Verhältnis des ionischen Produkts von Wasser: C.OΗ-= K.in/ S.Η += 10–14/ 5ˑ10-5= 2 · 10–10 mol / l.
Antwort: 5ˑ10-5 mol / l und 2ˑ10–10 mol / l.


























