
Proučavanje procesa koji se javljaju u statističkimsustavi, komplicirani minimalnom veličinom čestica i njihovim ogromnim brojem. Praktički je nemoguće svaku česticu razmatrati zasebno, stoga se uvode statističke veličine: prosječna brzina čestica, njihova koncentracija, masa čestice. Formula koja karakterizira stanje sustava uzimajući u obzir mikroskopske parametre naziva se osnovnom jednadžbom molekularno-kinetičke teorije plinova (MKT).
Prvo je bilo određivanje brzine kretanja česticaprovedeno eksperimentalno. Eksperiment poznat iz školskog programa, koji je izveo Otto Stern, omogućio je stvaranje ideje o brzini čestica. Tijekom eksperimenta istraženo je kretanje atoma srebra u rotirajućim cilindrima: prvo, u stacionarnom stanju postrojenja, a zatim tijekom njegovog okretanja s određenom kutnom brzinom.
Kao rezultat, utvrđeno je da brzina molekulasrebro premašuje brzinu zvuka i iznosi 500 m / s. Činjenica je prilično zanimljiva, jer je čovjeku teško osjetiti takvu brzinu kretanja čestica u tvarima.
Čini se mogućim nastaviti istraživanjesamo u sustavu čiji se parametri mogu odrediti izravnim mjerenjima pomoću fizičkih instrumenata. Brzina se mjeri brzinomjerom, ali ideja da se brzinomjer pričvrsti na jednu česticu je apsurdna. Samo se makroskopski parametar povezan s kretanjem čestica može izravno izmjeriti.
Bilo koji sustav tijela koja međusobno djelujukarakterizirana potencijalnom energijom i kinetičkom energijom kretanja. Pravi plin je složen sustav. Varijabilnost potencijalne energije ne podliježe sistematizaciji. Problem se može riješiti uvođenjem modela koji nosi karakteristična svojstva plina, uklanjajući složenost interakcije.
Idealan plin je stanje tvari u kojeminterakcija čestica je zanemariva, potencijalna energija interakcije teži nuli. Samo se energija kretanja, koja ovisi o brzini čestica, može smatrati značajnom.

Otkriti odnos tlaka i brzine plinagibanje njegovih čestica omogućuje osnovnu jednadžbu MKT idealnog plina. Čestica koja se kreće u posudi, nakon sudara sa zidom, prenosi na nju impuls čija se vrijednost može odrediti na temelju Newtonovog II zakona:
Promjena impulsa čestice tijekom elastičnog udara povezana je s promjenom vodoravne komponente njene brzine. F je sila koja djeluje na česticu na zid kratko vrijeme t; m0 - masa čestica.
Sve čestice plina, krećući se u smjeru površine brzinom vs a nalazi se u cilindru zapremine SυsΔt. Pri koncentraciji čestica n, točno polovica molekula kreće se prema zidu, druga polovica u suprotnom smjeru.
Razmotrivši sudar svih čestica, možemo napisati Newtonov zakon za silu koja djeluje na mjestu:
Budući da je tlak plina definiran kao omjer sile koja djeluje okomito na površinu i površinu potonje, možemo napisati:
Rezultirajuća relacija kao osnovna jednadžba MKT-a ne može opisati cijeli sustav, jer se uzima u obzir samo kretanje u jednom smjeru.
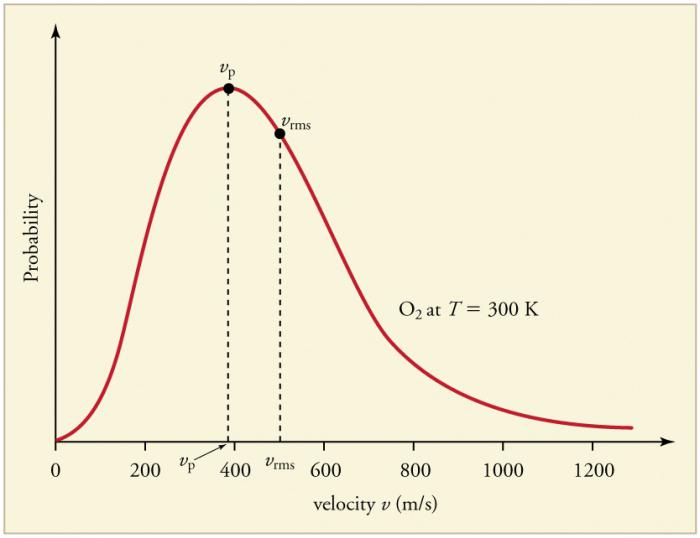
Neprekidni česti sudari čestica plina sazidovi i međusobno dovode do uspostavljanja određene statističke raspodjele čestica po brzinama (energijama). Smjerovi svih vektora brzine jednako su vjerojatni. Ta se raspodjela naziva Maxwellova raspodjela. 1860. godine ovaj je obrazac zaključio J. Maxwell na temelju MKT-a. Glavni parametri zakona o raspodjeli nazivaju se brzine: vjerojatne, koje odgovaraju maksimalnoj vrijednosti krivulje, i efektivne vrijednosti vkvadrat = √ ‹v2›- srednji kvadrat brzine čestica.
Porast temperature plina odgovara porastu vrijednosti brzine.
Na temelju činjenice da su sve brzine jednake i njihovi moduli imaju jednaku vrijednost, možemo uzeti u obzir:
Osnovna jednadžba MKT, uzimajući u obzir prosječnu vrijednost tlaka plina, ima oblik:
Ovaj omjer jedinstven je po tome što određuje odnos između mikroskopskih parametara: brzine, mase čestica, koncentracije čestica i tlaka plina općenito.
Koristeći koncept kinetičke energije čestica, osnovna jednadžba MKT može se prepisati drugačije:
Tlak plina proporcionalan je prosječnoj kinetičkoj energiji njegovih čestica.
Zanimljivo je da za konstantnu količinu plina uzatvorenu posudu, možete povezati tlak plina i prosječnu vrijednost energije gibanja čestica. U tom se slučaju mjerenje tlaka može izvesti mjerenjem energije čestica.
Kako nastaviti? Koja se količina može usporediti s kinetičkom energijom? Ispada da je ova vrijednost temperatura.


Zanimljiviji u smislu neovisnosti odsvojstva radne tekućine mogu se smatrati plinskim termometrima. Njihova skala neovisna je o vrsti plina koji se koristi. U takvom uređaju može se hipotetski odabrati temperatura pri kojoj tlak plina teži nuli. Izračuni pokazuju da ova vrijednost odgovara -273,15 okoIZ. Ljestvica temperature (skala apsolutne temperature ili Kelvinova skala) uvedena je 1848. godine. Kao glavna točka ove ljestvice uzeta je moguća temperatura nultog tlaka plina. Jedinični segment ljestvice jednak je jediničnoj vrijednosti Celzijeve skale. Prikladnije je napisati osnovnu jednadžbu MKT pomoću temperature pri proučavanju plinskih procesa.
Empirijski možete biti sigurni da je tlak plina proporcionalan njegovoj temperaturi. Istodobno je utvrđeno da je tlak izravno proporcionalan koncentraciji čestica:
gdje je T apsolutna temperatura, k je konstantna vrijednost jednaka 1,38 • 10-23J / K.
Temeljna veličina koja ima konstantnu vrijednost za sve plinove naziva se Boltzmannova konstanta.
Uspoređujući ovisnost tlaka o temperaturi i osnovnu jednadžbu plinova MKT, može se napisati:
Prosječna vrijednost kinetičke energije gibanja molekula plina proporcionalna je njezinoj temperaturi. Odnosno, temperatura može poslužiti kao mjera kinetičke energije gibanja čestica.


























