
Rješenja su homogeni sustavi kojisadrže dvije ili više komponenti, kao i proizvode koji su rezultat interakcije tih komponenata. Mogu biti u krutom, tekućem ili plinovitom stanju. Razmotrimo tekuće stanje agregacije otopina. Uključuju otapalo i tvar otopljenu u njemu (potonje je manje).
Koligacijska svojstva otopina su takvakarakteristike koje su izravno ovisne samo o otapalu i koncentraciji otopine. Također se nazivaju kolektivnim ili općim. Koligacijska svojstva otopina očituju se u smjesama u kojima nema kemijske interakcije između njihovih sastavnih komponenata. Uz to, sile međusobnog djelovanja između čestica otapala i čestica otapala i tvari otopljene u njemu jednake su u idealnim otopinama.
Koligativna svojstva otopina:
1) Tlak pare niži je nad otopinom nego nad otapalom.
2) Kristalizacija otopine odvija se na temperaturi nižoj od temperature kristalizacije otapala u čistom obliku.
3) Otopina vrije na višoj temperaturi od točke vrenja samog otapala.
4) Fenomen osmoze.

Razmotrimo koligativna svojstva odvojeno.
Ravnoteža na granici faze u zatvorenom sustavu:tekućina - para karakterizira pritisak zasićene pare. Budući da je u otopini dio površinskog sloja ispunjen molekulama otopljene tvari, ravnoteža će se postići pri nižem tlaku pare.
Drugo koligativno svojstvo je redukcijatemperatura kristalizacije otopine u usporedbi s otapalom - zbog činjenice da čestice otopljene tvari ometaju stvaranje kristala i na taj način sprječavaju kristalizaciju smanjenjem temperature.
Tačka ključanja smjese veća je od temperature vrelišta otapala učisti oblik, zbog činjenice da se jednakost atmosferskog tlaka i tlaka zasićene pare postiže većim zagrijavanjem, budući da su neke molekule otapala povezane s česticama otopljene tvari.

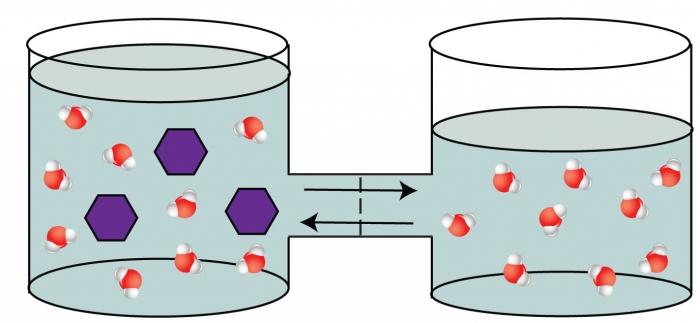
Četvrto koligativno svojstvo otopina je fenomen osmoze.
Fenomen osmoze je sposobnost otapalamigriraju kroz pregradu koja je propusna za neke čestice (molekule otapala), a nepropusna za druge (molekule otopljene tvari). Ova pregrada razdvaja otopinu visoke otopljene tvari od manje koncentrirane otopine. Primjer takvog polupropusnog septuma je membrana žive stanice, goveđeg mjehura itd. Pojava osmoze uzrokovana je izjednačavanjem koncentracija s obje strane, odvojene membranom, što je termodinamički povoljnije za sustav. Kako se otapalo pomiče u koncentriraniju otopinu, opaža se porast tlaka u ovom dijelu posude. Taj se višak tlaka naziva osmotski.
Koligacijska svojstva neelektrolitnih otopina mogu se matematički prikazati jednadžbama:
∆ Vrelište = Vrelište ∙ cm;
∆ Tcr. = Kzam ∙ Cm;
π = CRT.
Numerička svojstva sudaranjarazlikuju se za otopine elektrolita i otopine koje nisu elektroliti. Za prve su nešto veće. To je zbog činjenice da se u njima događa elektrolitska disocijacija, a broj čestica se znatno povećava.
Koligacijska svojstva otopina su široko rasprostranjenaPrimjena u svakodnevnom životu i proizvodnji, na primjer, pojava osmoze koristi se za dobivanje čiste vode. U živim organizmima mnogi se sustavi također temelje na koligacijskim svojstvima otopina (na primjer, rast biljnih stanica).


























