
Termodinamika mint önálló szakaszA fizika a 19. század első felében merült fel. Egy évszázad autó ütött. Az ipari forradalom a hőmotorok működésével kapcsolatos folyamatok tanulmányozásához és megértéséhez szükséges. A gépkorszak hajnalán az egyes feltalálók csak az intuíciót és a „piszkáló módszert” használhatták. A felfedezések és találmányok nem voltak közrendek, senki sem tudta elképzelni, hogy hasznosak lehetnek. De amikor a termikus (és egy kicsit később az elektromos) gépek a gyártás alapjává váltak, a helyzet megváltozott. A tudósok végül fokozatosan rendezték a terminológiai zavart, amely a XIX. Század közepéig uralkodott, és eldöntötték, hogy mit hívjunk energiának, milyen erőnek, mi - impulzusnak.
Kezdjük közismert információkkal.A klasszikus termodinamika számos posztuláción (alapelven) alapul, amelyeket egymás után vezettek be a XIX. Században. Vagyis ezek a rendelkezések a keretén belül nem bizonyíthatók. Ezeket az empirikus adatok szintézisének eredményeként fogalmazták meg.
Az első lépés a természetvédelmi törvény alkalmazásaenergia a makroszkopikus rendszerek viselkedésének leírására (nagyszámú részecskékből áll). Röviden, az alábbiak szerint fogalmazható meg: az izolált termodinamikai rendszer belső energiaellátása mindig állandó.
A termodinamika második törvényének célja annak meghatározása, hogy az ilyen rendszerekben milyen folyamatok alakulnak ki.
A harmadik elv lehetővé teszi egy olyan mennyiség pontos meghatározását, mint például az entrópia. Nézzük meg részletesebben.
A termodinamika második törvényének megfogalmazása a következő volt1850-ben javasolta Rudolf Clausius: "Lehetetlen a hő spontán átvitele kevésbé fűtött testből egy melegebb testbe." Ugyanakkor Clausius hangsúlyozta Sadi Carnot érdemeit, aki már 1824-ben megállapította, hogy a hőmotorhoz fordítható energia aránya csak a melegítő és a hűtőszekrény közötti hőmérséklet-különbségtől függ.

A második kezdet továbbfejlesztéséveltermodinamika Clausius bevezeti az entrópia fogalmát - egy olyan energiamennyiség mértékét, amely visszafordíthatatlanul olyan formába megy, amely nem alkalmas a munkavégzésre. Clausius ezt a mennyiséget a dS = dQ / T képlettel fejezte ki, ahol dS, amely meghatározza az entrópia változását. itt:
dQ a hőváltozás;
T az abszolút hőmérséklet (ugyanaz, mint a kelvinben mért hőmérséklet).
Egy egyszerű példa:érintse meg autójának motorháztetőjét járó motorral. Nyilvánvalóan melegebb, mint a környezet. Az autó motorját azonban nem úgy tervezték, hogy melegítse a motorháztetőt vagy a vizet a hűtőben. A benzin kémiai energiáját hővé, majd mechanikussá alakítva hasznos munkát végez - forgatja a tengelyt. De a keletkező hő nagy része elveszik, mivel ebből semmilyen hasznos munka nem nyerhető ki, és ami kipufogócsőből repül, már nem benzin. Ebben az esetben a hőenergia elveszik, de nem tűnik el, hanem eloszlik (eloszlik). A forró motorháztető természetesen lehűl, és a motor hengereinek minden ciklusa ismét meleget ad hozzá. Így a rendszer termodinamikai egyensúly elérésére törekszik.
Clausius egy általános alapelvet vezette le a második kezdetheztermodinamika a dS ≥ 0 képletben. Fizikai jelentése az entrópia „nem csökkenő” értékeként definiálható: reverzibilis folyamatokban nem változik, visszafordíthatatlan folyamatokban növekszik.
Meg kell jegyezni, hogy minden valós folyamatvisszafordíthatatlan. A "nem csökkenő" kifejezés csak azt a tényt tükrözi, hogy az elméletileg lehetséges idealizált változatot a jelenség megfontolása is tartalmazza. Vagyis a spontán folyamatokban elérhetetlen energia mennyisége növekszik.
Max Planck nagyban hozzájárult atermodinamika. A második törvény statisztikai értelmezésén túlmenően aktív szerepet vállalt a termodinamika harmadik törvényének posztulálásában. Az első megfogalmazás Walter Nernsté, és 1906-ra utal. Nernst tétele az egyensúlyi rendszer viselkedését az abszolút nullára eső hőmérsékleten veszi figyelembe. A termodinamika első és második elve lehetetlenné teszi, hogy kiderítsük, mi lesz az entrópia ezekben a körülmények között.

T = 0 K-nál az energia nulla, a rendszer részecskéiállítsa le a kaotikus hőmozgásokat és hozzon létre rendezett struktúrát, egy kristályt, amelynek termodinamikai valószínűsége egyenlő. Ez azt jelenti, hogy az entrópia is eltűnik (alább megtudjuk, miért történik ez). A valóságban még egy kicsit korábban is megteszi, ebből következik, hogy minden termodinamikai rendszert, bármely testet nem lehet abszolút nullára hűteni. A hőmérséklet önkényesen megközelíti ezt a pontot, de nem éri el.
Clausius így általánosította és megfogalmazta a termodinamika első és második elvét: bármely zárt rendszer teljes energiája mindig állandó, és a teljes entrópia az idő múlásával növekszik.
E nyilatkozat első része tiltjaaz első típusú örökmozgás gépe - olyan eszköz, amely külső forrásból származó energia beáramlás nélkül végez munkát. A második rész tiltja a második típusú örökmozgás gépet is. Egy ilyen gép a rendszer energiáját működésbe hozná, entrópiakompenzáció nélkül, a természetvédelmi törvény megsértése nélkül. Lehetséges az egyensúlyi rendszerből hő kiürítése, például sült tojás sütése vagy acél öntsége a vízmolekulák hőmozgásának energiája felhasználásával, miközben lehűti.
A termodinamika második és harmadik alapelve tiltja a második típusú örökmozgás gépet.
Sajnos a természetből semmi nem szerezhető be, nemcsak hiába, hanem jutalékot kell fizetniük.

A tudományban kevés olyan koncepció létezik, amelyet idéztek előannyira kétértelmű érzelmek vannak nemcsak a lakosság körében, hanem maguk a tudósok között is, hogy mekkora az entrópia. A fizikusok, és mindenekelőtt maga Clausius, szinte azonnal extrapolálták a nem-csökkenő törvényt a Földre, majd az egész Univerzumra (miért ne, mert ez termodinamikai rendszernek is tekinthető). Ennek eredményeként a fizikai mennyiséget, amely számos műszaki alkalmazásban a számítások fontos eleme, egy általános univerzális gonosz megtestesülésének kezdett tekinteni, amely elpusztítja a fényes és jó világot.
В среде ученых есть и такие мнения:mivel a termodinamika második törvénye szerint az entrópia visszafordíthatatlanul növekszik, előbb vagy utóbb az Univerzum minden energiája diffúz formává romlik, és "hőhalál" lesz. Mit lehet élvezni? Például Clausius több éven át nem mertek közzétenni következtetéseit. A „hőhalál” hipotézis természetesen sok kifogást felvetett. Még mindig komoly kétségek merülnek fel annak helyességével kapcsolatban.
1867-ben James Maxwell, az egyik szerzőA gázok molekuláris-kinetikai elmélete egy nagyon vizuális (bár kitalált) kísérletben megmutatta a termodinamika második törvényének látszólagos paradoxonját. Röviden: a tapasztalatok a következőképpen foglalhatók össze.
Legyen egy gáztartály.A benne levő molekulák véletlenszerűen mozognak, sebességük kissé eltér, de az átlagos kinetikus energia azonos az egész edényben. Most ossza meg az edényt egy válaszfallal két elkülönített részre. A molekulák átlagos sebessége az ér mindkét felében változatlan marad. A partíciót egy apró démon őrzi, amely lehetővé teszi a gyorsabb, „forró” molekulák behatolását az egyik részbe, a lassabb „hideg” a másikba. Ennek eredményeként a gáz felmelegszik az első felében és lehűl a második felében, vagyis a termodinamikai egyensúlyi állapotból a rendszer áttér a hőmérsékleti potenciálkülönbségre, ami az entrópia csökkenését jelenti.
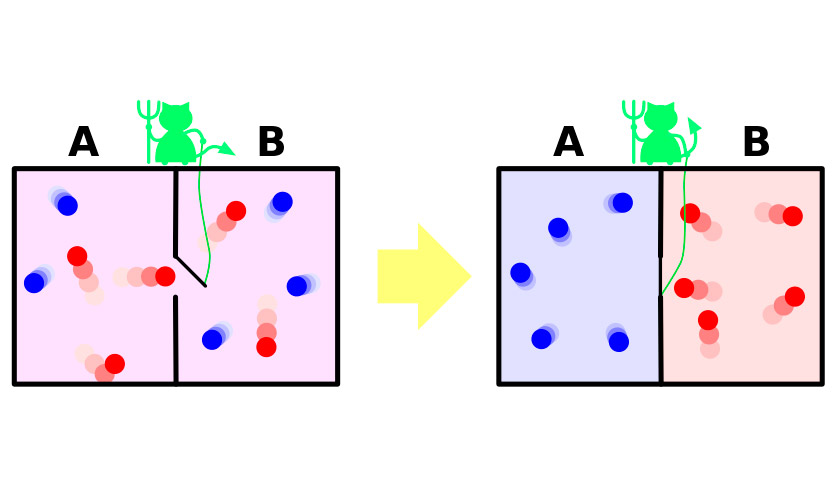
Вся проблема в том, что в эксперименте система ezt az átmenetet nem spontán módon hajtja végre. Kívülről energiát kap, amelynek eredményeként a partíció kinyílik és bezáródik, vagy a rendszer szükségszerűen tartalmaz egy démont, amely energiáját a kapuőr feladataira költi. A démon entrópiájának növekedése bőségesen fedezi a gáz csökkenését.
Vegyünk egy pohár vizet és hagyjuk az asztalon.Az üveg figyelése nem szükséges, elegendő egy idő után visszatérni és ellenőrizni a benne lévő víz állapotát. Látni fogjuk, hogy mennyisége csökkent. Ha hosszabb ideig elhagyja az üveget, akkor benne nincs víz, mivel az összes elpárolog. A folyamat legelején az összes vízmolekula az üveg falai által határolt bizonyos térrészben volt. A kísérlet végén szétszóródtak az egész helyiségben. A helyiség térfogatában a molekuláknak sokkal több lehetősége van helyük megváltoztatására, anélkül, hogy a rendszer állapotát befolyásolnák. Nem tudjuk összegyűjteni őket egy forrasztott „csapatban”, és visszaadni egy pohárba, hogy egészségügyi okokból vizet inni.

Ez azt jelenti, hogy a rendszer tovább fejlődöttmagasabb entrópiával rendelkező állam. A termodinamika második törvénye alapján az entrópia vagy a részecskék szétszóródása egy rendszerben (ebben az esetben a vízmolekulákban) visszafordíthatatlan. Miért van ez így?
Clausius nem válaszolt erre a kérdésre, és senki más nem tudta megtenni Ludwig Boltzmann előtt.
1872-ben ez a tudós bevezette a tudományta termodinamika második törvényének statisztikai értelmezése. Valójában a makroszkopikus rendszereket, amelyekkel a termodinamika foglalkozik, sok elem alkotja, amelyek viselkedése betartja a statisztikai törvényeket.
Vissza a vízmolekulákhoz.A szoba körül véletlenszerűen repülve különböző pozíciókat foglalhat el, van némi eltérés a sebességben (a molekulák folyamatosan ütköznek egymással és a levegőben lévő többi részecskével). A molekuláris rendszer állapotának minden variánsát mikrosztatikus állapotnak nevezzük, és nagyon sok ilyen változat létezik. A lehetőségek túlnyomó többségének végrehajtásakor a rendszer makrosztatikus állapota semmilyen módon nem változik.
A híres S = k lnW reláció összekapcsolja a számota termodinamikai rendszer (W) egy adott makrosztatikus állapotának kifejezésének lehetséges módjai S entrópiájával. A W értékét termodinamikai valószínűségnek nevezzük. A képlet végső formája Max Planck lett. A k együttható rendkívül kis érték (1,38 × 10-23 J / K), amely az energia és a hőmérséklet kapcsolatát jellemzi, Planck Boltzmann állandóját nevezi annak a tudósnak a tiszteletére, aki először javasolta a termodinamika második törvényének statisztikai értelmezését.

Nyilvánvaló, hogy W mindig pozitív egész szám, 1, 2, 3, ... N(nincs törtszámú módon). Akkor a W logaritmusa és ezért az entrópia nem lehet negatív. A rendszer egyetlen lehetséges mikrosztatikus állapotában az entrópia nullával egyenlő. Ha visszatérünk az üvegünkhöz, ez a posztulátum a következőképpen ábrázolható: a helyiség körül véletlenszerűen scurring vízmolekulák visszatértek az üveghez. Ugyanakkor mindegyik pontosan megismételte az útját, és ugyanabban a helyen vette be az üveget, ahol az indulás előtt volt. Semmi sem tiltja ennek a lehetőségnek a megvalósítását, amelyben az entrópia nulla. Csak várni kell egy ilyen eltűnően kicsi valószínűség megvalósulására. Ez egy példa arra, amit csak elméletileg lehet megtenni.
Tehát a molekulák véletlenszerűen repülnek körül a helyiségbenkülönböző módon. Nincs szabályszerűség a helyükön, nincs rend a rendszerben, függetlenül attól, hogy miként változtatja meg a mikrotáblák beállításait, nincs különálló szerkezete. Az üveg ugyanaz volt, de a korlátozott hely miatt a molekulák nem változtak pozíciójukban olyan aktívan.
A rendszer kaotikus, rendezetlen állapotamivel a legvalószínűbb megfelel annak maximális entrópiájának. Az üvegben lévő víz az alacsonyabb entrópiás állapot példája. A helyiségben egyenletesen elosztott káoszból való áttérés gyakorlatilag lehetetlen.
Adunk egy példát, amely érthetőbb mindannyiunk számára -megtisztítani a rendetlenséget a házban. Annak érdekében, hogy mindent a helyére tegyünk, energiát kell költenünk. E munka során forrássá válik számunkra (vagyis nem fagyunk be). Kiderül, hogy az entrópia hasznos lehet. Ez így van. Még többet mondhatunk: entrópia, és ezen keresztül a termodinamika második törvénye (az energiával együtt) az univerzumot irányítja. Vessen egy másik pillantást a reverzibilis folyamatokra. Tehát a világ úgy néz ki, ha nincs entrópia: nincs fejlődés, nincs galaxis, csillag, bolygó. Nincs élet ...

Kicsit több információ a "termikus halálról".Van jó hír. Mivel a statisztikai elmélet szerint a „tiltott” folyamatok valószínűleg nem valószínűek, a termodinamikai egyensúlyi rendszerben ingadozások lépnek fel - ez a termodinamika második törvényének spontán megsértése. Tetszőlegesen nagyok lehetnek. Ha a gravitációt belefoglalják a termodinamikai rendszerbe, akkor a részecskék eloszlása nem lesz véletlenszerűen egyenletes, és a maximális entrópia állapota sem lesz elérve. Ezenkívül az Univerzum nem állandó, állandó, stacionárius. Következésképpen a "hőhalál" kérdésének megfogalmazása értelmetlen.


























