
化学は魅力的な科学です。理論だけでなく、実際に自分のスキルを試すことに興味がある人は、それが何であるかを正確に知っています。すべての学生は、周期表のほとんどの要素に精通しています。しかし、誰もが自分の経験を試して試薬を混合し、化学試験を実施することができましたか?今日でも、すべての現代の学校が必要な機器と試薬を持っているわけではないので、化学は独立した研究のために開かれた科学のままです。多くの人が家で研究をすることによってそれについてもっと学びたいと思っています。

窒素なしでできるDIYerは一人もいません酸は家庭で非常に重要です。入手困難:専門店でしか購入できず、平和使用を確認する書類に基づいて購入します。したがって、あなたが自家製のマスターである場合、あなたはおそらくこのコンポーネントを手に入れることができないでしょう。ここで、家庭で硝酸を作る方法について疑問が生じます。プロセスは複雑ではないようですが、それでも、出力は十分なレベルの純度と必要な濃度の物質でなければなりません。ここでは、実験化学者のスキルなしではできません。
硝酸の使用は合理的で安全です。この物質は、人間の活動のそのような領域で使用されます。

純粋な硝酸は、変化せず、空気と接触すると白い蒸気を放出し始める液体物質のように見えます。すでに-42でフリーズします oC、+ 80で沸騰 oC.自宅で自分の手で硝酸などの物質を取り除く方法は?
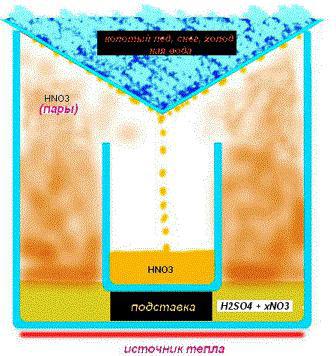
発煙物質は硝酸ナトリウム(カリウム)に対する硫酸濃縮物の影響(ナトリウム(カリウム)硝酸塩)。反応の結果、目的の物質と硫酸水素ナトリウム(カリウム)が得られます。反応スキームは次のようになります。 NaNO3+X2CO4=>HNO3+NaHSO4. 得られる物質の濃度は、反応に入る前の硫酸の濃度に依存することを忘れないでください。
自宅で硝酸を取得する同じように低濃度の物質が発生するため、硝酸ナトリウムを硝酸アンモニウムに置き換えるだけで済みます。化学方程式は次のようになります。 NN4しかし3+X2CO4=>(NN4)2CO4+HNO3. 硝酸アンモニウムは、硝酸カリウムまたは硝酸ナトリウムよりも容易に入手できることに注意してください。そのため、ほとんどの研究者はそれに基づいて反応を行います。

Hの濃度が高いほど2CO4、より濃縮された窒素酸。バランスの取れた物質を得るには、反応に必要な電解質の量を増やす必要があります。望ましい結果を達成するために、実際には、電解質の量を最初の量の約4分の1に徐々に減らす蒸発法を使用します。
ふるいにかけた砂を皿の底に注ぎ、置きます電解質リザーバー。この場合、沸騰プロセスはガスストーブのバルブによって調整され、火を与えたり減らしたりします。プロセスは長いので、そのような問題では忍耐が重要です。専門家はボイラーの使用を推奨しています-蒸発を含む化学実験用に設計されたガラスまたはセラミックチューブ。それらは気泡の形成を中和し、飛沫を防ぐことによって沸騰力を減らします。このような条件下では、家庭で約93%の濃度の硝酸を得ることが許容されます。
反応を実行するには、次のものが必要です。
他の化学反応を実行するのと同様に、自宅で硝酸を入手するには、次の予防措置が必要です。
これで、簡単な反応で硝酸を作る方法がわかりました。この物質に注意し、平和目的でのみ使用してください。
