
아세틸렌의 구조는 특성, 생산 및 사용에 영향을 미칩니다. 물질의 구성 기호 - C2H2 - 이것은 가장 단순하고 총체적인 공식입니다.아세틸렌은 두 개의 탄소 원자에 의해 형성되며 그 사이에서 삼중 결합이 발생합니다. 그것의 존재는 물질의 성질에 대한 구조의 영향에 대한 문제를 이해하는 것을 가능하게하는 ethin 분자의 다양한 공식과 모델을 반영합니다.
탄화수소 알킨 또는 아세틸렌은비 환식, 불포화. 탄소 원자의 사슬은 닫히지 않으며, 단순하고 다중 결합을 포함한다. 알킨의 조성은 복합 제형 C씨.X2n - 2. 이 종류의 물질 분자에서하나 이상의 삼중 결합. 아세틸렌 화합물은 불포화입니다. 이것은 단지 하나의 탄소 원자가가 수소 때문이라는 것을 의미합니다. 나머지 3 개의 결합은 다른 탄소 원자와의 상호 작용에 사용됩니다.
Первый - и наиболее известный представитель 알키 닌 - 아세틸렌 또는 에틴. 물질의 사소한 이름은 라틴어 인 "acetum"- "식초"와 그리스 - "hyle"- "tree"에서 유래합니다. 상 동성 시리즈의 조상은 1836 년 화학 실험에서 발견되었으며, 나중에 물질은 E. Devi and M. Berthelot (1862)에 의해 석탄과 수소로부터 합성되었다. 상온 및 상압에서 아세틸렌은 기체 상태이다. 무색의 무취이며 물에 잘 녹지 않는다. 에틴은 에탄올과 아세톤에 용해되기 쉽습니다.

Etin은 동종 계열의 가장 단순한 구성원이며, 그 구성과 구조는 다음과 같은 공식을 반영합니다.
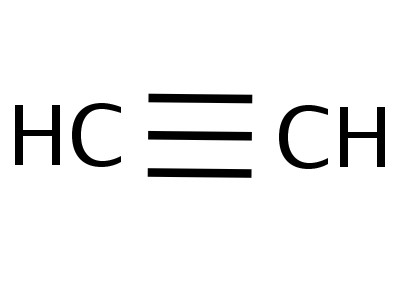
Формулы, показывающие распределение электронов, 원자 궤도 모형의 생성을위한 기초, 분자의 공간 공식 (입체 화학적). 18 세기 말에 볼 베어링 모델이 널리 보급되었습니다. 예를 들어 아세틸렌을 형성하는 탄소와 수소를 나타내는 다양한 색상과 크기의 공 등이 있습니다. 분자의 구조식은 화학 결합과 각 원자에서의 숫자를 상징하는 막대 형태로 표현됩니다.
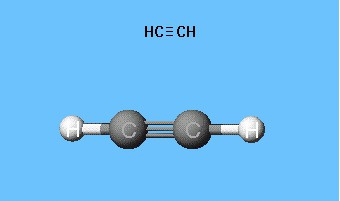
아세틸렌 롤러 스틱 모델 재생산결합 각은 180 °이지만 분자 내의 핵간 거리는 대략적으로 반영된다. 공 사이의 공극은 전자 밀도로 원자 공간을 채우는 아이디어를 만들지 않습니다. 단점은 Dreyding 모델에서 제거됩니다.이 모델은 볼에 의해서가 아니라 막대가 서로 붙는 지점에서 원자핵을 지정합니다. 현대적인 체적 모델은 원자와 분자 궤도의 더 생생한 아이디어를 제공합니다.
여기 상태의 탄소는 세 개의 p 오비탈과 짝이없는 전자를 가진 하나의 π 오비탈을 포함한다. 메탄 (CH4) 그들은 동등한 가치 창조에 관여한다.수소 원자와의 결합. 유명한 미국 연구원 인 L. Pauling은 원자 궤도 함수 (AO)의 하이브리드 상태 이론을 개발했습니다. 화학 반응에서 탄소의 거동에 대한 설명은 AO를 모양과 에너지, 새로운 구름의 형성에 맞추는 것이다. 하이브리드 궤도는 더 강한 연결을 제공하며 공식은보다 안정적이됩니다.
아세틸렌 분자의 탄소 원자는메탄은 sp- 하이브리드 화를 거친다. 모양과 에너지는 s와 p 전자를 혼합합니다. 두 개의 sp 오비탈이 180 ° 각도로 나타나 핵의 반대쪽으로 향하게됩니다.

아세틸렌 하이브리드 카본 전자 구름같은 이웃하는 원자들과 C-H 쌍들에 수소를 가진 σ- 결합의 생성에 참여한다. 두 개의 비 하이브리드 p- 오비탈은 서로 수직입니다. ethin의 분자에서, 그들은 두 개의 π- 결합의 형성에 관여한다. σ와 함께 삼중 결합이 생겨 구조적 공식에 반영됩니다. 아세틸렌은 에탄과 에틸렌과 원자 사이의 거리가 다릅니다. 삼중 결합은 두 배보다 짧지 만 큰 에너지를 보유하고 더 내구성이 있습니다. σ- 및 π- 결합의 최대 밀도는 수직 영역에 위치하며, 이로 인해 원통형 전자 구름이 형성된다.
에틴 분자는 선형 형태를 가지며, 이것은 성공적이다.아세틸렌 -H-C≡C-H의 화학식을 반영한다. 탄소와 수소 원자는 하나의 직선을 따라 가며, 3 σ-와 2 π- 결합이 그들 사이에서 발생한다. 자유로운 움직임, C-C 축을 따르는 회전은 불가능합니다. 이것은 다중 본드의 존재로 인해 방지됩니다. 다른 트리플 본드 기능 :
에탄 및 에틸렌 분자에서 단일 및 이중 화학 결합의 길이는 각각 1.54 및 1.34 nm이며, C – C 차단 에너지는 348 kJ / mol, C = C-614 kJ / mol입니다.

아세틸렌은 알킨의 가장 간단한 대표 물질이며, 분자에는 삼중 결합이 있습니다. 프로 핀 CH3С≡СН는 아세틸렌 동족체이다. 알킨의 세 번째 대표 공식-부틴 -1-CH3CH2С≡СН. 아세틸렌은 에틴의 사소한 이름입니다. 알킨의 체계적인 명명법은 IUPAC 규칙을 따릅니다.

에틴과 프로 핀에는 삼중 위치 이성질체가 없습니다연결, 그들은 부틴으로 시작합니다. 탄소 골격의 이성질체는 펜틴과 그 뒤를 따르는 동족체에서 발견됩니다. 아세틸렌 탄화수소의 공간적 이성질체는 삼중 결합과 관련하여 나타나지 않습니다.
ethyne의 처음 4 개 동족체는 물에 잘 녹지 않는 기체입니다. 아세틸렌 탄화수소 C5 - 씨15 -액체. 고체는 탄화수소 C로 시작하는 에틴 동족체입니다.17... 알킨 테스트의 화학적 성질삼중 결합의 중요한 영향. 이 유형의 탄화수소는 에틸렌보다 더 활동적이며 다양한 입자를 부착합니다. 이 속성은 산업 및 기술 분야에서 ethyne이 널리 사용되는 기반입니다. 아세틸렌이 타면 다량의 열이 방출되어 가스 절단 및 금속 용접에 사용됩니다.
