
70-aisiais išgarsėjusi frazė „ozono sluoksnis“kas dvejus metus praėjusį šimtmetį, jau seniai buvo užbrėžtas. Tuo pačiu nedaugelis žmonių iš tikrųjų supranta, ką reiškia ši sąvoka ir koks pavojingas yra ozono sluoksnio sunaikinimas. Dar didesnė paslaptis daugeliui yra ozono molekulės struktūra, ir iš tikrųjų ji yra tiesiogiai susijusi su ozono sluoksnio problemomis. Sužinokime daugiau apie ozoną, jo struktūrą ir pramoninę paskirtį.
Ozonas arba, kaip jis dar vadinamas, aktyvusis deguonis, yra žydros dujos, turinčios aštrų metalinį kvapą.

Ši medžiaga gali egzistuoti visose trijose agregacijos būsenose: dujinėse, kietose ir skystose.
Tuo pačiu metu gamtoje ozonas randamas tik dujų pavidalu, formuojant vadinamąjį ozono sluoksnį. Dėl dangaus žydros spalvos dangus atrodo mėlynas.
Ozonas gavo savo slapyvardį „aktyvus deguonis“dėl jo panašumo į deguonį. Taigi pagrindinis aktyvus šių medžiagų cheminis elementas yra deguonis (O). Tačiau jei deguonies molekulėje yra 2 jos atomai, tai ozono molekulė (formulė - O3) susideda iš 3 šio elemento atomų.
Dėl šios struktūros ozono savybės yra panašios į deguonies, tačiau ryškesnės. Visų pirma, kaip ir O2, O.3 yra stipriausias oksidatorius.
Svarbiausias skirtumas tarp šių „susijusių“medžiagos, kurias gyvybiškai svarbu prisiminti, yra šios: ozonu negalima kvėpuoti, jis yra toksiškas ir įkvėpus gali pakenkti plaučiams ar net užmušti žmogų. Be to, O3 puikiai tinka oro valymui nuo toksinių priemaišų. Beje, būtent dėl to taip lengva kvėpuoti po lietaus: ozonas oksiduoja ore esančias kenksmingas medžiagas ir jis yra išgryninamas.
Ozono molekulės modelis (sudarytas iš 3 atomųdeguonis) šiek tiek primena kampo vaizdą, o jo dydis yra 117 °. Ši molekulė neturi nesuporuotų elektronų, todėl yra diamagnetinė. Be to, jis turi poliškumą, nors ir susideda iš to paties elemento atomų.
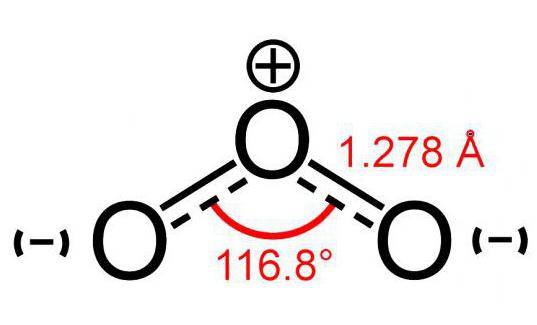
Du šios molekulės atomai yra tvirtai surištisave. Bet ryšys su trečiuoju yra mažiau patikimas. Dėl šios priežasties ozono molekulė (modelio nuotrauką galima pamatyti žemiau) yra labai trapi ir netrukus po susidarymo suyra. Paprastai bet kokiai O skilimo reakcijai3 išsiskiria deguonis.
Dėl ozono nestabilumo jo neįmanoma įsigyti ir laikyti, taip pat transportuoti kaip ir kitas medžiagas. Dėl šios priežasties jo gamyba yra brangesnė nei kitų medžiagų.
Tuo pačiu metu didelis O aktyvumas3 leidžia šiai medžiagai būti stipriausiu oksidatoriumi, galingesniu nei deguonis ir saugesniu už chlorą.
Jei ozono molekulė sunaikinta ir O2, šią reakciją visada lydi energijos išsiskyrimas. Tuo pačiu metu, kad įvyktų atvirkštinis procesas (susidaro O3 nuo maždaug2), būtina išleisti bent jau tai.
Dujinėje būsenoje ozono molekulėsuyra 70 ° C temperatūroje. Jei ji bus padidinta iki 100 laipsnių ar daugiau, reakcija žymiai pagreitės. Priemaišų buvimas taip pat pagreitina ozono molekulių irimo periodą.
Kad ir kurioje iš trijų ozono valstybių būtų, jis išlaiko mėlyną spalvą. Kuo kietesnė medžiaga, tuo šis atspalvis yra sodresnis ir tamsesnis.

Kiekviena ozono molekulė sveria 48 g / mol. Jis yra sunkesnis už orą, kuris padeda atskirti šias medžiagas.
Apie3 geba oksiduoti beveik visus metalus ir nemetalus (išskyrus auksą, iridį ir platiną).
Be to, ši medžiaga gali dalyvauti degimo reakcijoje, tačiau tam reikalinga aukštesnė temperatūra nei O2.
Ozonas sugeba ištirpti H2Apie ir freonai. Skystoje būsenoje jis gali maišytis su skystu deguonimi, azotu, metanu, argonu, anglies tetrachloridu ir anglies dioksidu.
O molekulės3 susidaro prie deguonies molekulių prijungus laisvuosius deguonies atomus. Savo ruožtu jie atsiranda dėl kitų O molekulių skilimo2 dėl elektros iškrovų poveikio jiems,ultravioletiniai spinduliai, greiti elektronai ir kitos didelės energijos dalelės. Dėl šios priežasties specifinis ozono kvapas jaučiamas šalia kibirkščiuojančių elektros prietaisų ar lempų, skleidžiančių ultravioletinę šviesą.

Pramoniniu mastu O3 išmetamas naudojant elektrinius ozono generatorius arba ozonizatorius. Šiuose įtaisuose aukštos įtampos elektros srovė perduodama per dujų srautą, kuriame O2, kurio atomai yra ozono „statybinė medžiaga“.
Kartais į šiuos prietaisus pumpuojamas grynas deguonis arba įprastas oras. Gauto ozono kokybė priklauso nuo pradinio produkto grynumo. Taigi, medicinos O3, skirtas žaizdoms gydyti, išgaunamas tik iš chemiškai gryno O2.
Išsiaiškinus, kaip atrodo ir kaip susidaro ozono molekulė, verta susipažinti su šios medžiagos istorija.
Pirmiausia ją susintetino olandaityrinėtojas Martinas Van Marumas XVIII a. antroje pusėje. Mokslininkas pastebėjo, kad praleidus elektros kibirkštis per indą su oru, jame esančios dujos pakeitė savo savybes. Tuo pačiu metu Van Marumas nesuprato, kad jis išskyrė naujos medžiagos molekules.
O štai jo kolega vokietis Scheinbein vardu bando suardyti H2O ant N ir O2, atkreipė dėmesį į naujų aštraus kvapo dujų išsiskyrimą. Atlikęs daugybę tyrimų, mokslininkas apibūdino atrastą medžiagą ir suteikė jai pavadinimą „ozonas“, pagerbdamas graikišką žodį „kvapas“.
Gebėjimas naikinti grybus ir bakterijas, taip pat sumažinti kenksmingų junginių, kuriuos turėjo atvira medžiaga, toksiškumą, sulaukė daugelio mokslininkų susidomėjimo. 17 metų po oficialaus O3 Pirmąjį sukūrė Werneris von Siemensasprietaisas, leidžiantis sintetinti ozoną bet kokiu kiekiu. O po 39 metų puikus Nikola Tesla išrado ir užpatentavo pirmąjį pasaulyje ozono generatorių.
Būtent šis prietaisas, jau po 2 metų, buvo pirmasisnaudojamas Prancūzijoje geriamojo vandens valymo įrenginiuose. Su XX amžiaus pradžia. Europa pradeda pereiti prie geriamojo vandens ozonavimo, kad būtų išgryninta.
Rusijos imperija pirmą kartą naudojo šią techniką 1911 m., O praėjus 5 metams šalyje buvo įrengta beveik 4 dešimtys geriamojo vandens valymo ozonu įrenginių.
Šiandien chloravimas palaipsniui keičia vandens ozonavimą. Taigi 95% viso geriamojo vandens Europoje valoma O3... Ši technika taip pat labai populiari JAV. NVS šalyse jis vis dar tiriamas, nes, nors ši procedūra yra saugesnė ir patogesnė, ji yra brangesnė nei chlorinimas.
Be vandens valymo, Oh3 turi daugybę kitų taikymo sričių.
15-35 km atstumu virš Žemės paviršiaus yra ozono sluoksnis arba, kaip jis dar vadinamas, ozonosfera. Šioje vietoje koncentruotas O3 tarnauja kaip tam tikras kenksmingos saulės spinduliuotės filtras.
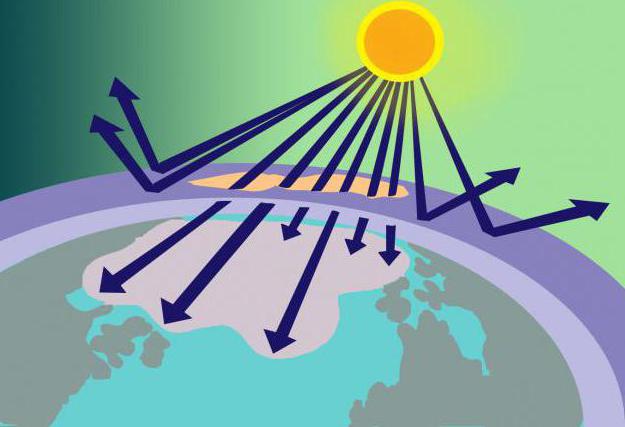
Iš kur toks medžiagos kiekis, jeiar jo molekulės nestabilios? Atsakymas į šį klausimą nesudėtingas, jei prisiminsime ozono molekulės modelį ir jo susidarymo metodą. Taigi deguonis, susidedantis iš 2 deguonies molekulių, patenkantis į stratosferą, ten yra kaitinamas saulės spindulių. Pasirodo, kad šios energijos pakanka O padalijimui2 į atomus, iš kurių O3... Tuo pačiu metu ozono sluoksnis ne tik sunaudoja dalį saulės energijos, bet ir ją filtruoja, sugeria pavojingą ultravioletinę šviesą.
Aukščiau buvo sakoma, kad ozoną tirpdo freonai.Šios dujinės medžiagos (naudojamos dezodorantų, gesintuvų ir šaldytuvų gamybai), patekusios į atmosferą, veikia ozoną ir prisideda prie jo irimo. Todėl ozonosferoje atsiranda skylių, per kurias į planetą patenka nefiltruoti saulės spinduliai, kurie destruktyviai veikia gyvus organizmus.
Įvertinus ozono molekulių ypatybes ir struktūrą, galima daryti išvadą, kad ši medžiaga, nors ir pavojinga, yra labai naudinga žmonijai, jei ji naudojama teisingai.


























