
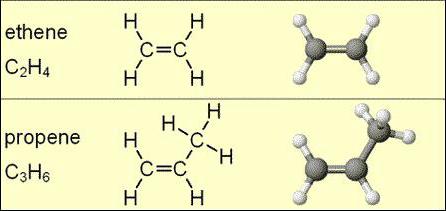
Paprasčiausi organiniai junginiai yra sočiųjų ir nesočiųjų angliavandenilių junginiai. Tai apima alkanų, alkinų, alkenų klasės medžiagas.

Jų formulėse yra vandenilio ir anglies atomai tam tikra seka ir kiekiu. Jie dažnai sutinkami gamtoje.
Kitas jų pavadinimas yra olefinai arba etileno angliavandeniliai. Būtent tai ir buvo vadinama ši junginių klasė XVIII amžiuje, kai buvo atrastas riebus skystis - etileno chloridas.
Alkenai apima medžiagas, susidedančias išvandenilio ir anglies elementai. Jie yra susiję su acikliniais angliavandeniliais. Jų molekulėje yra viena dviguba (nesočioji) jungtis, jungianti du anglies atomus vienas su kitu.
Kiekviena junginių klasė turi savo cheminį pavadinimą. Juose periodinės sistemos simboliai ir elementai nurodo kiekvienos medžiagos jungčių sudėtį ir struktūrą.

Bendra alkenų formulė nurodoma taip: CP.X2n, kur skaičius n yra didesnis arba lygus 2. Iššifruojant jį galima pamatyti, kad kiekviename anglies atome yra du vandenilio atomai.
Alkenų iš homologinių serijų molekulinės formulės pateikiamos šiomis struktūromis: C2X4, C3X6, C4X8, C5X10, C6X12, C7X14, C8X16, C9X18, C10X20. Galima pastebėti, kad kiekviename paskesniame angliavandenilyje yra dar viena anglis ir dar 2 vandenilis.
Grafiškai parodyta cheminių junginių, esančių tarp molekulės atomų, vieta ir tvarka, parodanti alkenų struktūrinę formulę. Naudojant valentinius brūkšnius, nurodomas anglies ryšys su vandeniliais.
Gali būti pavaizduota alkenų struktūrinė formulė.išplėstine forma, kai parodomi visi cheminiai elementai ir jungtys. Esant glaudesnei olefinų išraiškai, anglies ir vandenilio jungtis valentinių brūkšnių pagalba nėra parodyta.
Skeleto formulė žymi paprasčiausią struktūrą. Nutrūkusi linija vaizduoja molekulės pagrindą, kuriame anglies atomai yra pavaizduoti jos viršūnėmis ir galais, o jungtys nurodo vandenilį.
Remiantis sistemine nomenklatūra, formulealkenai ir jų pavadinimai sudaryti iš alkanų, priklausančių prisotintiems angliavandeniliams. Norėdami tai padaryti, pastarojo vardu priesaga -an pakeičiama -ylen arba -en. Pavyzdys yra butileno susidarymas iš butano, o pentenas - iš pentano.
Norėdami nurodyti dvigubos jungties vietą anglies atomų atžvilgiu, pavadinimo pabaigoje nurodykite arabišką skaičių.
Vardas Alkenes yra pagrįstas pavadinimuangliavandenilis su ilgiausia grandine, kurioje yra dviguba jungtis. Grandinės numeracijos pradžia paprastai pasirenkama ta pabaiga, kuri yra arčiausiai nesočiųjų anglies atomų junginio.
Jei alkenų struktūrinė formulė turišakas, tada nurodykite radikalų pavadinimus ir jų skaičių ir prieš juos sudėkite skaičius, atitinkančius vietą anglies grandinėje. Tada seka pats angliavandenilio pavadinimas. Po skaičių paprastai rašykite brūkšnelį.
Yra nesočiųjų radikalių šakų. Jų vardai gali būti nereikšmingi arba sudaryti pagal sisteminės nomenklatūros taisykles.
Pavyzdžiui, HHC = CH- yra vadinamas etenilu arba vinilu.
Alkenų molekulinės formulės negali parodyti izomerijos. Tačiau šiai medžiagų klasei, išskyrus etileno molekulę, būdinga erdvinė modifikacija.
Etileno angliavandenilių izomerai gali būti išilgai anglies skeleto, atsižvelgiant į nesočiųjų ryšių, tarpklasinės ar erdvinės padėtį.
Bendra alkenų formulė lemiaanglies ir vandenilio atomai grandinėje, tačiau dvigubos jungties buvimas ir vieta ant jos nėra matomi. Pavyzdys yra ciklopropanas kaip tarpklasinis izomeras C3X6 (propilenas). Kiti izomerijos tipai atsiranda C4X8 arba buteno.
Stebimos skirtingos nesočiųjų obligacijų padėtysbutenas-1 arba butenas-2, pirmuoju atveju dvigubas junginys yra šalia pirmojo anglies atomo, o antruoju - grandinės viduryje. Anglies skeleto izomeriją galima laikyti naudojant metilpropeną (CH3-C (CH3) = CH2) ir izobutileno ((CH3) 2C = CH2)
Erdvinė modifikacija būdinga butenui-2trans ir cis padėtis. Pirmuoju atveju šalutiniai radikalai yra virš ir žemiau pagrindinės anglies grandinės su dviguba jungtimi, antrame izomere pakaitai yra vienoje pusėje.
Bendra alkenų formulė lemia visų šios klasės atstovų fizinę būklę. Pradedant etilenu ir baigiant butilenu (nuo C)2 į C4), medžiagos yra dujinės formos. Taigi bespalvis etenas turi saldų kvapą, mažai tirpsta vandenyje, jo molekulinė masė yra mažesnė nei oro.
Skystos formos angliavandeniliai, kurių intervalas yra homologinis5 į C17... Pradedant alkenu, kurio pagrindinėje grandinėje yra 18 anglies atomų, įvyksta fizinės būsenos perėjimas į kietą formą.
Laikoma, kad visi olefinai blogai tirpinavandens aplinka, bet gerai organiniuose tirpikliuose, tokiuose kaip benzenas ar benzinas. Jų molekulinė masė yra mažesnė nei vandens. Anglies grandinės padidėjimas lemia temperatūros rodiklių padidėjimą lydant ir verdant šiuos junginius.
Struktūrinė alkenų formulė rodo jų buvimądviejų anglies atomų π- ir σ- junginių dvigubos jungties griaučiai. Ši molekulės struktūra lemia jos chemines savybes. Laikoma, kad π ryšys nėra labai stiprus, todėl jį galima sunaikinti susidarant dviem naujoms σ-jungtims, kurios gaunamos prisirišus atomų porai. Nesotieji angliavandeniliai yra elektroniniai donorai. Jie dalyvauja elektrofilinio prisijungimo procesuose.

Svarbi visų alkenų cheminė savybė yrahalogeninimo procesas išskiriant tokius junginius kaip dihalogenintos medžiagos. Halogeno atomai gali dvigubai prisijungti prie anglies. Pavyzdys yra propileno brominimas, kad susidarytų 1,2-dibromopropanas:
X2C = CH - CH3 + Br2 → BrCH2–CHBr - CH3.
Šis spalvų neutralizavimo brominiame vandenyje su alkenais procesas laikomas kokybiniu dvigubo ryšio buvimo įrodymu.
Svarbios reakcijos apima olifinų hidrinimąpridedant vandenilio molekulės veikiant kataliziniams metalams, tokiems kaip platina, paladis ar nikelis. Rezultatas yra angliavandeniliai su prisotintu ryšiu. Alkanų, alkenų formulės pateikiamos žemiau buteno hidrinimo reakcijoje:
H3–CH2–CH = CH2 + H2 Ni→ CH3–CH2–CH2–CH3.
Vadinamas vandenilio halogenido molekulės prijungimo prie olefinų procesas
hidrohalogeninimas, vykstantis pagal taisyklę,atrado Markovnikovas. Pavyzdys yra propileno hidrobrominimas iki 2-brompropano susidarymo. Jame vandenilis jungiasi su dviguba jungtimi su anglimi, kuri laikoma labiausiai hidrinta:
H3–CH = CH2 + HBr → CH3–BrCH - CH3.
Vandens pridėjimo alkenais reakcija veikiant rūgštims vadinama hidratacija. Rezultatas yra propanol-2 alkoholio molekulė:
H3–HC = CH2 + H2O → CH3–OHCH - CH3.
Kai alkenai yra veikiami sieros rūgšties, vyksta sulfoninimo procesas:
H3–HC = CH2 + HO - OSO - OH → CH3–CH3CH - O - SO2-OH.
Reakcija vyksta susidarant rūgštiniams esteriams, pavyzdžiui, izopropilsulfato rūgščiai.
Alkenai, degdami veikiami deguonies, yra jautrūs oksidacijai, kad susidarytų vanduo ir anglies dioksido dujos:
2CH3–HC = CH2 + 9O2 → 6CO2 + 6H2O.
Olefininių junginių irpraskiestas kalio permanganatas tirpalo pavidalu sukelia glikolių arba diatominių alkoholių susidarymą. Ši reakcija taip pat yra oksidacinė, susidarant etilenglikoliui ir tirpalo spalvos pokyčiams:
3H2C = CH2 + 4H2O + 2KMnO4 → 3OHCH - CHOH + 2MnO2 + 2KOH.
Alkenų molekulės gali dalyvauti polimerizacijoje su laisvųjų radikalų arba katijoninių-anijoninių mechanizmų pagalba. Pirmuoju atveju, veikiant peroksidams, gaunamas polietileno tipo polimeras.
Pagal antrąjį mechanizmą rūgštys veikia kaip katijoniniai katalizatoriai, o organinės metalinės medžiagos yra anijoninės, išskiriant stereoselektyvų polimerą.
Jie taip pat vadinami parafinais arba ribojančiaisacikliniai angliavandeniliai. Jie turi linijinę arba šakotą struktūrą, kurioje yra tik prisotintos paprastos jungtys. Visi šios klasės homologinių serijų atstovai turi bendrą formulę CP.X2n + 2.
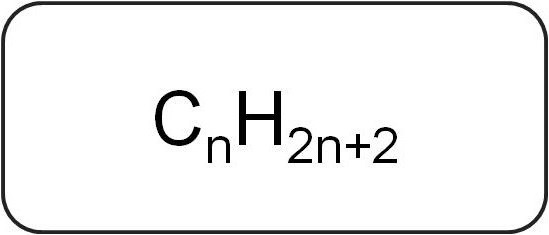
Juose yra tik anglies ir vandenilio atomai. Bendroji alkenų formulė yra kilusi iš sočiųjų angliavandenilių žymėjimo.
Paprasčiausias šios klasės atstovasyra metanas. Po jo eina tokios medžiagos kaip etanas, propanas ir butanas. Jų vardas pagrįstas skaitmens šaknis graikų kalba, prie kurios pridedama galūnė -an. Alkano pavadinimai yra išvardyti IUPAC nomenklatūroje.
Bendra alkenų, alkinų, alkanų formulė apimatik dviejų rūšių atomai. Tai apima anglies ir vandenilio elementus. Anglies atomų skaičius visose trijose klasėse yra vienodas, skirtumas pastebimas tik vandenilio skaičiuje, kurį galima atskirti arba prijungti. Nesotieji junginiai gaunami iš sočiųjų angliavandenilių. Parafinų atstovuose molekulėje yra 2 vandenilio atomai daugiau nei olefinų, o tai patvirtina bendra alkanų, alkenų formulė. Alkenų struktūra laikoma nesočiąja dėl dvigubo ryšio.
Jei koreliuosime vandenilio ir anglies atomų skaičių alkanuose, vertė bus didžiausia, palyginti su kitomis angliavandenilių klasėmis.
Pradedant metanu ir baigiant butanu (nuo C1 į C4), medžiagos yra dujinės formos.
Skystos formos angliavandeniliai, kurių intervalas yra homologinis5 į C16... Pradedant alkanu, kurio pagrindinėje grandinėje yra 17 anglies atomų, fizinė būsena virsta kieta forma.
Jiems būdinga anglies skeleto izomerija ir molekulės optinės modifikacijos.

Parafinuose atsižvelgiama į anglies valentusvisiškai užimtas kaimyninių anglies arba vandenilio, susidarant σ tipo ryšiui. Cheminiu požiūriu tai lemia silpnąsias jų savybes, todėl alkanai vadinami sočiaisiais arba sočiaisiais angliavandeniliais, neturinčiais giminingumo.
Jie pradeda pakaitines reakcijas, susijusias su radikaliu molekulės halogeninimu, sulfochlorinimu arba nitrinimu.
Parafinai oksiduojasi, deginami arba skyla esant aukštai temperatūrai. Veikiant reakcijos greitintuvams, pašalinami vandenilio atomai arba dehidrinami alkanai.
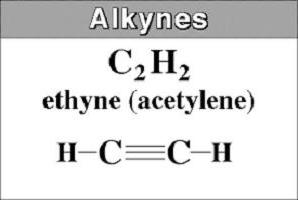
Jie taip pat vadinami acetileniniais angliavandeniliais, kurie anglies grandinėje turi trigubą jungtį. Alkinų struktūra apibūdinama bendra C formuleP.X2n - 2... Tai rodo, kad, skirtingai nei alkanai, acetileniniuose angliavandeniliuose trūksta keturių vandenilio atomų. Juos pakeičia triguba jungtis, suformuota dviejų π junginių.
Ši struktūra lemia šios klasės chemines savybes. Struktūrinė alkenų ir alkinų formulė aiškiai parodo jų molekulių nesotumą, taip pat dvigubo (H2C꞊CH2) ir trigubos (HC≡CH) jungtys.
Paprasčiausias atstovas yra acetilenasarba HC≡CH. Jis taip pat vadinamas etinu. Jis kilęs iš prisotinto angliavandenilio pavadinimo, kuriame pašalinama galūnė -an ir pridedama -in. Ilgųjų alkinų pavadinimuose skaičius nurodo trigubos jungties vietą.
Žinant sočiųjų angliavandenilių struktūrą irnesočiųjų, galima nustatyti, kuri raidė žymi bendrą alkinų formulę: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Trečias variantas yra teisingas atsakymas.
Pradedant acetilenu ir baigiant butanu (nuo C)2 į C4), medžiagos yra dujinio pobūdžio.
Skystoje formoje yra angliavandeniliai, kurių intervalas yra homologinis nuo C5 į C17... Pradedant alkinu, kurio pagrindinėje grandinėje yra 18 anglies atomų, įvyksta fizinės būsenos perėjimas į kietą formą.
Jiems būdinga izomerija anglies skelete, trigubos jungties padėtyje, taip pat molekulės modifikacijos tarp klasių.
Pagal chemines savybes acetileniniai angliavandeniliai yra panašūs į alkenus.
Jei alkinai turi galutinį trigubą ryšį, tada jie turiatlikti rūgšties funkciją susidarant alkinido druskoms, pavyzdžiui, NaC≡CNa. Dėl dviejų π jungčių natrio acetiledino molekulė tampa stipriu nukleofilu, kuris patenka į pakaitines reakcijas.
Acetilenas chloruojamas dalyvaujant vario chloridui, kad gautų dichloracetileną. Kondensuojasi veikiant halogenalkinams, išsiskiriant diacetileno molekulėms.
Alkinai dalyvauja adicijos reakcijoseelektrofilinis, kurio principas yra halogeninimo, hidrohalogeninimo, hidratacijos ir karbonilinimo pagrindas. Tačiau tokie procesai yra silpnesni nei dvigubą jungtį turinčių alkenų.
Acetileniniams angliavandeniliams yra galimos alkoholio, pirminio amino arba vandenilio sulfido molekulės nukleofilinės adicijos reakcijos.


























