
Cechy strukturalne acetylenu wpływają na jego właściwości, produkcję i zastosowanie. Symbolem składu substancji jest C2N.2 - To jest najprostsza i wulgarna formuła.Acetylen składa się z dwóch atomów węgla, między którymi występuje potrójne wiązanie. Jego obecność znajduje odzwierciedlenie w różnego rodzaju formułach i modelach cząsteczki etyny, które pozwalają zrozumieć problem wpływu struktury na właściwości substancji.
Węglowodory alkinowe lub acetylenacykliczny, nienasycony. Łańcuch atomów węgla nie jest zamknięty, zawiera proste i wielokrotne wiązania. Skład alkinów odzwierciedla skonsolidowany wzór C.PanX2n - 2. W cząsteczkach substancji tej klasy jest obecnyjedno lub więcej potrójnych wiązań. Związki acetylenowe są nienasycone. Oznacza to, że tylko jedna wartościowość węgla jest realizowana z powodu wodoru. Pozostałe trzy wiązania są używane w interakcji z innymi atomami węgla.
Pierwszy - i najbardziej znany przedstawicielalkiny - acetylen lub etyna. Trywialna nazwa substancji pochodzi od łacińskiego słowa „acetum” - „ocet” i greckiego - „hyle” - „drzewo”. Założyciel serii homologicznej odkryto w 1836 r. W eksperymentach chemicznych, później substancję zsyntetyzowano z węgla i wodoru przez E. Davy'ego i M. Berthelota (1862). W zwykłej temperaturze i normalnym ciśnieniu atmosferycznym acetylen jest w stanie gazowym. Jest to bezbarwny gaz, bezwonny, trudno rozpuszczalny w wodzie. Etyna jest łatwiej rozpuszczalna w etanolu i acetonie.

Etin jest najprostszym członkiem swojej homologicznej serii, a jego skład i struktura odzwierciedlają wzory:
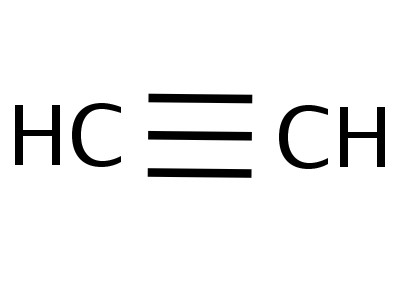
Wzory pokazujące rozkład elektronów,posłużył jako podstawa do stworzenia atomowych modeli orbitalnych, formuł przestrzennych cząsteczek (stereochemicznych). Już pod koniec XVIII wieku popularne stały się modele kulowe - na przykład kulki o różnych kolorach i rozmiarach, reprezentujące węgiel i wodór, które tworzą acetylen. Wzór strukturalny cząsteczki jest przedstawiony w postaci prętów symbolizujących wiązania chemiczne i ich ilość w każdym atomie.
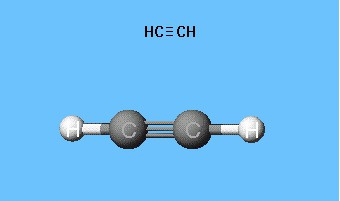
Model acetylenu z kulistym prętem się odtwarzaKąty walencyjne 180 °, ale odległości między jądrami w cząsteczce są odzwierciedlone w przybliżeniu. Pustki między kulkami nie stwarzają pomysłu na wypełnienie przestrzeni atomów gęstością elektronów. Wadę eliminuje się w modelach Drading, które oznaczają jądra atomowe nie za pomocą kulek, ale przez punkty połączenia prętów ze sobą. Nowoczesne modele wolumetryczne dają bardziej żywe wyobrażenie o orbitali atomowych i molekularnych.
Węgiel w stanie wzbudzonym zawiera trzy p-orbitale i jeden s z niesparowanymi elektronami. W tworzeniu metanu (CH4) biorą udział w tworzeniu ekwiwalentuwiąże się z atomami wodoru. Słynny amerykański badacz L. Pauling opracował doktrynę hybrydowego stanu orbitali atomowych (AO). Wyjaśnienie zachowania węgla w reakcjach chemicznych ma na celu wyrównanie AO kształtu i energii, tworzenie nowych chmur. Hybrydowe orbitale dają silniejsze wiązania, formuła staje się bardziej stabilna.
W przeciwieństwie do atomów węgla w cząsteczce acetylenumetan ulega hybrydyzacji sp. W kształcie i energii elektrony s i p są mieszane. Pojawiają się dwie orbitale sp, leżące pod kątem 180 °, skierowane po przeciwnych stronach jądra.

W acetylenie hybrydowe chmury elektronowo-węgloweuczestniczyć w tworzeniu wiązań σ z tymi samymi sąsiadującymi atomami i wodorem w parach C - H. Pozostają dwa niehybrydowe p-orbity prostopadłe do siebie. W cząsteczce etyny uczestniczą w tworzeniu dwóch wiązań π. Wraz z σ powstaje potrójne wiązanie, co znajduje odzwierciedlenie we wzorze strukturalnym. Acetylen różni się od etanu i etylenu odległością między atomami. Potrójne wiązanie jest krótsze niż podwójne, ale ma duży zapas energii, jest bardziej trwałe. Maksymalna gęstość wiązań σ i π znajduje się w obszarach prostopadłych, co prowadzi do powstania cylindrycznej chmury elektronów.
Cząsteczka etyny ma liniowy kształt, który jest udanyodzwierciedla wzór chemiczny acetylenu - H - C≡C - H. Atomy węgla i wodoru znajdują się wzdłuż jednej linii prostej, powstają między nimi wiązania 3 σ i 2 π. Swobodny ruch, obrót wzdłuż osi C - C jest niemożliwy, zapobiega temu obecność wielu wiązań. Inne cechy potrójnego wiązania:
Dla porównania: w cząsteczkach etanu i etylenu długość pojedynczego i podwójnego wiązania chemicznego wynosi odpowiednio 1,54 i 1,34 nm, energia zrywająca C - C wynosi 348 kJ / mol, C = C - 614 kJ / mol.

Acetylen jest najprostszym przedstawicielem alkinów, w cząsteczkach których występuje również potrójne wiązanie. Propin CH3С≡СН - homolog acetylenu. Wzór trzeciego przedstawiciela alkinów - butin-1 - CH3CH2С≡СН. Acetylen to banalna nazwa etyny. Systematyczna nomenklatura alkinów jest zgodna z zasadami IUPAC:

Etyna i propina nie mają izomerów potrójnej pozycjipołączenie pojawiają się, zaczynając od butin. Walentynki i kolejne homologi mają izomery szkieletu węglowego. W odniesieniu do wiązania potrójnego przestrzenny izomeria węglowodorów acetylenowych nie występuje.
Pierwsze 4 homologi etyny to gazy słabo rozpuszczalne w wodzie. Węglowodory acetylenowe C5 - C15 - płyny. Ciała stałe są homologami etynowymi rozpoczynającymi się od węglowodoru C.17. Występuje chemiczna natura alkinówznaczący wpływ potrójnego wiązania. Węglowodory tego typu są bardziej aktywne niż etylen, łączą różne cząsteczki. Powszechne stosowanie etyki w przemyśle i technologii opiera się na tej właściwości. Podczas spalania acetylenu uwalnia się duża ilość ciepła, która jest wykorzystywana do cięcia gazowego i spawania metali.


























