
A frase "camada de ozônio" que se tornou famosa nos anos 70biênio século passado, há muito que está no limite. Ao mesmo tempo, poucas pessoas realmente entendem o que esse conceito significa e quão perigosa é a destruição da camada de ozônio. Um mistério ainda maior para muitos é a estrutura da molécula de ozônio e, de fato, está diretamente relacionada aos problemas da camada de ozônio. Vamos descobrir mais sobre o ozônio, sua estrutura e aplicações industriais.
Ozônio, ou, como também é chamado, oxigênio ativo, é um gás azul com um odor metálico pungente.

Esta substância pode existir em todos os três estados de agregação: gasoso, sólido e líquido.
Ao mesmo tempo, na natureza, o ozônio é encontrado apenas na forma de gás, formando a chamada camada de ozônio. É por causa de sua cor azul que o céu parece azul.
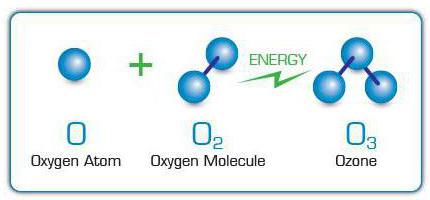
O ozônio recebeu o apelido de "oxigênio ativo"devido à sua semelhança com o oxigênio. Portanto, o principal elemento químico ativo nessas substâncias é o oxigênio (O). No entanto, se a molécula de oxigênio contém 2 de seus átomos, a molécula de ozônio (fórmula - O3) consiste em 3 átomos deste elemento.
Devido a essa estrutura, as propriedades do ozônio são semelhantes às do oxigênio, mas mais pronunciadas. Em particular, como O2, SOBRE3 é o agente oxidante mais forte.
A diferença mais importante entre esses "relacionados"As substâncias que todos devem lembrar são as seguintes: o ozônio não pode ser respirado, é tóxico e, se inalado, pode causar danos aos pulmões ou até matar uma pessoa. Além disso, O3 perfeito para purificação do ar de impurezas tóxicas. A propósito, é precisamente por isso que é tão fácil respirar depois da chuva: o ozônio oxida as substâncias nocivas contidas no ar e é purificado.
Modelo de molécula de ozônio (consistindo em 3 átomosoxigênio) lembra ligeiramente a imagem de um ângulo e seu tamanho é 117 °. Esta molécula não possui elétrons desemparelhados, portanto é diamagnética. Além disso, possui polaridade, embora seja composto por átomos do mesmo elemento.
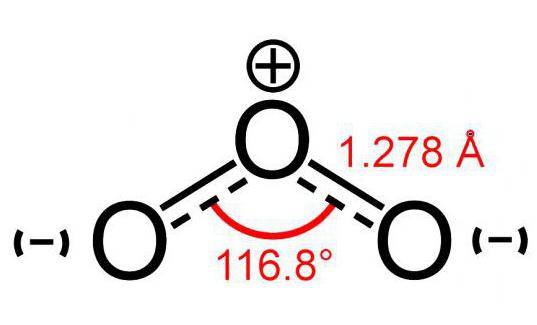
Os dois átomos desta molécula estão firmemente ligados entrevocê mesmo. Mas a conexão com o terceiro é menos confiável. Por isso, a molécula de ozônio (a foto do modelo pode ser vista abaixo) é muito frágil e se decompõe logo após sua formação. Como regra, para qualquer reação da decadência de O3 o oxigênio é liberado.
Devido à instabilidade do ozônio, é impossível adquiri-lo e armazená-lo, bem como transportá-lo como outras substâncias. Por isso, sua produção é mais cara do que outras substâncias.
Ao mesmo tempo, a alta atividade de O3 permite que esta substância seja o oxidante mais forte, mais poderoso do que o oxigênio e mais seguro do que o cloro.
Se a molécula de ozônio for destruída e O2, essa reação é sempre acompanhada pela liberação de energia. Ao mesmo tempo, para que ocorra o processo reverso (a formação de O3 de cerca de2), é necessário gastá-lo pelo menos.
No estado gasoso, a molécula de ozôniodecompõe-se a 70 ° C. Se for aumentado para 100 graus ou mais, a reação irá acelerar significativamente. A presença de impurezas também acelera o período de decomposição das moléculas de ozônio.
Qualquer um dos três estados em que o ozônio está, ele mantém sua cor azul. Quanto mais dura a substância, mais rica e escura é esta tonalidade.

Cada molécula de ozônio pesa 48 g / mol. É mais pesado que o ar, o que ajuda a separar essas substâncias entre si.
Oh3 capaz de oxidar quase todos os metais e não metais (exceto ouro, irídio e platina).
Além disso, esta substância pode participar da reação de combustão, mas isso requer uma temperatura mais alta do que para O2.
O ozônio é capaz de se dissolver em H2Sobre e freons. No estado líquido, ele pode se misturar com oxigênio líquido, nitrogênio, metano, argônio, tetracloreto de carbono e dióxido de carbono.
Moléculas O3 são formados ligando átomos de oxigênio livres às moléculas de oxigênio. Eles, por sua vez, aparecem devido à clivagem de outras moléculas O2 devido ao impacto sobre eles de descargas elétricas,raios ultravioleta, elétrons rápidos e outras partículas de alta energia. Por esta razão, o cheiro específico de ozônio pode ser sentido próximo a faíscas de aparelhos elétricos ou lâmpadas que emitem luz ultravioleta.

Em escala industrial O3 emitidos por geradores elétricos de ozônio ou ozonizadores. Nestes dispositivos, uma corrente elétrica de alta tensão é passada através de um fluxo de gás no qual O2, cujos átomos servem como "material de construção" para o ozônio.
Às vezes, oxigênio puro ou ar comum é injetado nesses dispositivos. A qualidade do ozônio resultante depende da pureza do produto inicial. Então, médico O3, destinado ao tratamento de feridas, é extraído apenas de O quimicamente puro2.
Depois de descobrir a aparência da molécula de ozônio e como ela se forma, vale a pena conhecer a história dessa substância.
Foi sintetizado pela primeira vez pelos holandesespesquisador Martin Van Marum na segunda metade do século XVIII. O cientista percebeu que, depois de passar faíscas elétricas por um recipiente com ar, o gás contido nele mudou suas propriedades. Ao mesmo tempo, Van Marum não entendeu que havia isolado as moléculas de uma nova substância.
E aqui está seu colega alemão de nome Scheinbein, tentando decompor H2O em N e O2, chamou a atenção para o lançamento de um novo gás com odor pungente. Depois de realizar muitas pesquisas, o cientista descreveu a substância que descobriu e deu-lhe o nome de "ozônio" em homenagem à palavra grega para "cheiro".
A capacidade de matar fungos e bactérias, bem como de reduzir a toxicidade de compostos nocivos que a substância aberta possuía, interessou a muitos cientistas. 17 anos após a abertura oficial do O3 Werner von Siemens projetou o primeiroum dispositivo que permite sintetizar ozônio em qualquer quantidade. E 39 anos depois, o brilhante Nikola Tesla inventou e patenteou o primeiro gerador de ozônio do mundo.
Foi este dispositivo que, após 2 anos, foi o primeirousado na França em estações de tratamento de água potável. Com início do século XX. A Europa começa a migrar para a ozonização da água potável para sua purificação.
O Império Russo usou essa técnica pela primeira vez em 1911 e, 5 anos depois, quase 4 dúzias de instalações de purificação de água potável com ozônio foram equipadas no país.
Hoje, a ozonização da água está substituindo gradualmente a cloração. Assim, 95% de toda a água potável na Europa é purificada com O3... Essa técnica também é muito popular nos EUA. No CIS, ainda está em estudo, pois, embora seja mais seguro e conveniente, é mais caro que a cloração.
Além da purificação da água, Oh3 tem uma série de outras áreas de aplicação.
A uma distância de 15-35 km acima da superfície da Terra, existe a camada de ozônio, ou, como também é chamada, a ozonosfera. Neste lugar, concentrado O3 serve como uma espécie de filtro para a radiação solar prejudicial.
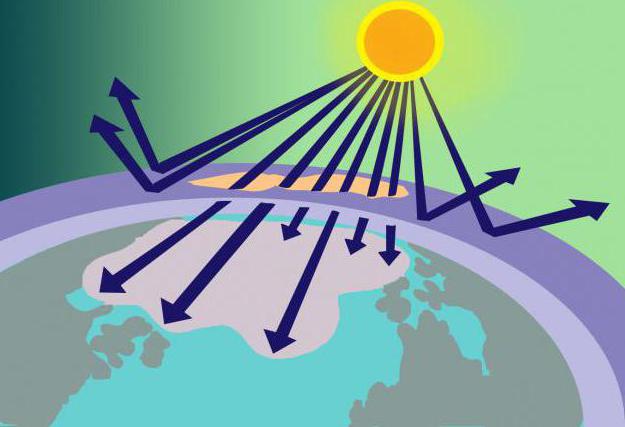
De onde vem essa quantidade de substância, sesuas moléculas são instáveis? A resposta a esta pergunta não é difícil se lembrarmos o modelo da molécula de ozônio e o método de sua formação. Então, o oxigênio, que consiste em 2 moléculas de oxigênio, entrando na estratosfera, é aquecido pelos raios solares. Essa energia acaba sendo suficiente para dividir O2 nos átomos a partir dos quais O é formado3... Ao mesmo tempo, a camada de ozônio não só usa parte da energia solar, mas também a filtra, absorve a perigosa luz ultravioleta.
Foi dito acima que o ozônio é dissolvido por freons.Essas substâncias gasosas (utilizadas na fabricação de desodorantes, extintores de incêndio e refrigeradores), uma vez liberadas na atmosfera, afetam o ozônio e contribuem para sua decomposição. Como resultado, surgem buracos na ozonosfera, através dos quais raios solares não filtrados entram no planeta, afetando destrutivamente os organismos vivos.
Tendo considerado as características e estrutura das moléculas de ozônio, pode-se chegar à conclusão de que essa substância, embora perigosa, é muito útil para a humanidade se usada corretamente.


























