
A história do estudo da radioatividade começou no dia 1º de março.1896, quando o famoso cientista francês Henri Becquerel descobriu acidentalmente uma raridade na emissão de sais de urânio. Acontece que as chapas fotográficas localizadas na mesma caixa com a amostra foram iluminadas. Isso foi causado pela radiação estranha e altamente penetrante que o urânio possuía. Essa propriedade foi encontrada nos elementos mais pesados no final da tabela periódica. Ele recebeu o nome de "radioatividade".
Este processo é uma transformação espontâneaátomo de um isótopo de um elemento em outro isótopo com a liberação simultânea de partículas elementares (elétrons, núcleos de átomos de hélio). A transformação dos átomos acabou sendo espontânea, não exigindo a absorção de energia de fora. A principal quantidade que caracteriza o processo de liberação de energia no decaimento radioativo é chamada de atividade.
А = λN, onde λ é a constante de decaimento, N é o número de átomos ativos na amostra.
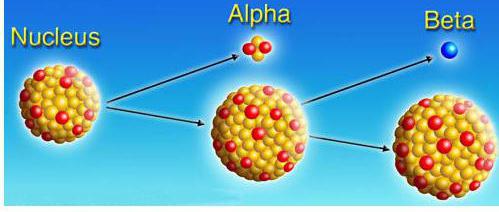
Alocar decaimentos α, β, γ. As equações correspondentes são chamadas de regras de deslocamento:
nome | O que está acontecendo | Equação de reação |
α - decadência | transformação de um núcleo atômico X em um núcleo Y com a liberação do núcleo de um átomo de hélio | ZUmX→Z-2YA-4+2Ele4 |
β - decadência | transformação de um núcleo atômico X em um núcleo Y com a liberação de um elétron | ZUmX→Z + 1YUm+-1eUm |
γ - decadência | não acompanhada por uma mudança no núcleo, a energia é liberada na forma de uma onda eletromagnética | ZXUm→ZXUm+ γ |
O ponto de desintegração de partículas não pode ser definido paradeste átomo particular. Para ele, é mais um "acidente" do que um padrão. A liberação de energia que caracteriza esse processo é definida como a atividade da amostra.

É estabelecido que há um tempo duranteem que exatamente metade dos átomos de uma determinada amostra sofre decadência. Este intervalo de tempo é denominado "meia-vida". Qual é o sentido de introduzir este conceito?
Parece que por um tempo igual ao períodoexatamente metade de todos os átomos ativos em uma determinada amostra decai. Mas isso significa que em um tempo de duas meias-vidas, todos os átomos ativos irão decair completamente? De modo nenhum. Após um determinado momento, metade dos elementos radioativos permanecem na amostra, após o mesmo período de tempo outra metade dos átomos restantes decai e assim por diante. Nesse caso, a radiação persiste por muito tempo, ultrapassando significativamente a meia-vida. Isso significa que os átomos ativos são preservados na amostra, independentemente da radiação
A meia-vida é um valor que depende exclusivamente das propriedades de uma determinada substância. O valor da quantidade foi determinado para muitos isótopos radioativos conhecidos.
| Nome | Notação | Tipo de deterioração | Meia vida |
Rádio | 88Ra219 | alfa | 0,001 segundos |
Magnésio | 12Mg27 | beta | 10 minutos |
Radon | 86Rn222 | alfa | 3,8 dias |
Cobalto | 27Co60 | beta, gama | 5,3 anos |
Rádio | 88Ra226 | alfa, gama | 1620 anos |
Urano | 92você238 | alfa, gama | 4,5 bilhões de anos |
Determinação de meia-vida concluídaexperimentalmente. No decorrer dos testes de laboratório, a atividade é medida repetidamente. Como as amostras de laboratório são de tamanho mínimo (a segurança do pesquisador é fundamental), o experimento é realizado em diferentes intervalos de tempo, repetindo-se várias vezes. Baseia-se na regularidade das mudanças na atividade das substâncias.
Com o propósito de determinar a meia-vidaa atividade de uma determinada amostra é medida em determinados intervalos. Levando em consideração que este parâmetro está associado ao número de átomos decaídos, usando a lei do decaimento radioativo, a meia-vida é determinada.

Seja o número de elementos ativos do isótopo investigado em um determinado momento N, o intervalo de tempo durante o qual a observação é t2- t1onde os momentos do início e do fim da observação estão próximos o suficiente. Vamos supor que n é o número de átomos decaindo em um determinado intervalo de tempo, então n = KN (t2- t1).
Nessa expressão, K = 0,693 / T½ é o coeficiente de proporcionalidade, chamado de constante de decaimento. T½ é a meia-vida do isótopo.
Vamos considerar o intervalo de tempo como uma unidade. Nesse caso, K = n / N indica a fração dos núcleos presentes do isótopo que decai por unidade de tempo.
Conhecendo o valor da constante de decaimento, é possível determinar a meia-vida de decaimento: T½ = 0,693 / K.
Disto se segue que não um certo número de átomos ativos decai por unidade de tempo, mas uma certa fração deles.
A meia-vida é a base do RRP.O padrão foi deduzido por Frederico Soddy e Ernest Rutherford com base nos resultados de estudos experimentais em 1903. É surpreendente que múltiplas medições realizadas com dispositivos longe da perfeição nas condições do início do século XX, tenham levado a um resultado preciso e comprovado. Ele se tornou a base da teoria da radioatividade. Vamos derivar um registro matemático da lei da decadência radioativa.

- Let N0 - o número de átomos ativos em um determinado momento. Após a expiração do intervalo de tempo t, N elementos permanecem não decaídos.
- No momento de tempo igual à meia-vida, exatamente metade dos elementos ativos permanecerá: N = N0/ 2.
- Após outra meia-vida, a amostra permanece: N = N0/ 4 = N0/ 22 átomos ativos.
- Após um tempo igual a mais uma meia-vida, a amostra retém apenas: N = N0/ 8 = N0/ 23.
- No momento em que n meias-vidas tiverem passado, N = N permanecerá na amostra0/ 2O senhor partículas ativas. Nesta expressão, n = t / T½: a razão entre o tempo de estudo e a meia-vida.
- ZRR tem uma expressão matemática ligeiramente diferente, mais conveniente na resolução de problemas: N = N02-t / T½.
A regularidade permite que você determine, além demeia-vida, o número de átomos de isótopos ativos que não decaíram em um determinado momento. Conhecendo o número de átomos da amostra no início da observação, depois de algum tempo é possível determinar o tempo de vida da preparação dada.
A fórmula da lei do decaimento radioativo ajuda a determinar a meia-vida apenas na presença de certos parâmetros: o número de isótopos ativos na amostra, que é bastante difícil de descobrir.
É possível escrever a fórmula do RRR usando os conceitos de atividade e massa dos átomos da droga.
A atividade é proporcional ao número de átomos radioativos: A = A0• 2-t / T... Nesta fórmula A0 - atividade da amostra no momento inicial, A - atividade após t segundos, T - meia-vida.
A massa de uma substância pode ser usada no seguinte padrão: m = m0• 2-t / T
Durante quaisquer intervalos iguais de tempo, exatamente a mesma proporção de átomos radioativos disponíveis em uma determinada preparação decai.
A lei é estatística em todos os sentidos,definir os processos que ocorrem no micromundo. É claro que a meia-vida dos elementos radioativos é um valor estatístico. A natureza probabilística dos eventos em núcleos atômicos sugere que um núcleo arbitrário pode se desfazer a qualquer momento. É impossível prever um evento; você só pode determinar sua probabilidade em um determinado momento. Como consequência, a meia-vida não tem sentido:

A existência do átomo em seu originalestado pode durar um segundo e talvez milhões de anos. Também não há necessidade de falar sobre a vida útil de uma determinada partícula. Apresentando um valor igual ao valor médio da vida útil dos átomos, pode-se falar sobre a existência de átomos de um isótopo radioativo, as consequências do decaimento radioativo. A meia-vida de um núcleo atômico depende das propriedades do átomo dado e não depende de outras quantidades.
É possível resolver o problema: como encontrar a meia-vida, sabendo o tempo médio de vida?
A fórmula para a relação entre a vida média de um átomo e a constante de decaimento ajuda a determinar a meia-vida nada menos.
τ = T1/2/ ln2 = T1/2/ 0,693 = 1 / λ.
Nesta notação, τ é o tempo de vida médio, λ é a constante de decaimento.
O uso de RRR para determinar a idade do indivíduoos espécimes se espalharam pela pesquisa no final do século XX. A precisão de determinar a idade dos artefatos fósseis aumentou tanto que pode dar uma ideia do tempo de vida por milênios AC.
Análise de radiocarbono de fóssil orgânicoAs amostras são baseadas em mudanças na atividade do carbono-14 (um isótopo radioativo do carbono) presente em todos os organismos. Ele entra em um organismo vivo durante o metabolismo e está contido nele em certa concentração. Após a morte, o metabolismo com o meio ambiente para. A concentração de carbono radioativo diminui devido à decomposição natural, a atividade diminui proporcionalmente.
Dado um valor como a meia-vida, a fórmula da lei da decadência radioativa ajuda a determinar o tempo decorrido desde o fim da atividade vital do corpo.

Estudos de radioatividade foram realizados emcondições de laboratório. A incrível capacidade dos elementos radioativos de permanecerem ativos por horas, dias e até anos surpreendeu os físicos do início do século XX. Estudos, por exemplo, do tório, foram acompanhados de um resultado inesperado: sua atividade em uma ampola fechada era significativa. Com a menor respiração, ela caiu. A conclusão acabou sendo simples: a transformação do tório é acompanhada pela liberação de radônio (gás). Todos os elementos do processo de radioatividade são convertidos em uma substância completamente diferente, diferindo tanto em propriedades físicas quanto químicas. Essa substância, por sua vez, também é instável. Atualmente, três séries de transformações semelhantes são conhecidas.
O conhecimento de tais transformações é extremamente importante emdeterminação do tempo de inacessibilidade de zonas contaminadas no processo de pesquisa atômica e nuclear ou em desastres. A meia-vida do plutônio - dependendo de seu isótopo - varia de 86 anos (Pu 238) a 80 milhões de anos (Pu 244). A concentração de cada isótopo dá uma ideia do período de desinfecção da área.
É sabido que existem metais em nosso temposignificativamente mais caro do que ouro, prata e platina. Isso inclui o plutônio. É interessante que o plutônio criado no processo de evolução não ocorre na natureza. A maioria dos elementos é obtida em condições de laboratório. A exploração do plutônio-239 em reatores nucleares permitiu que ele se tornasse extremamente popular nos dias de hoje. A obtenção de quantidade suficiente desse isótopo para uso em reatores torna-o praticamente inestimável.

O plutônio-239 é produzido naturalmentecomo consequência da cadeia de transformações do urânio-239 em neptúnio-239 (meia-vida - 56 horas). Uma cadeia semelhante torna possível acumular plutônio em reatores nucleares. A taxa de aparecimento da quantidade necessária excede a taxa natural em bilhões de vezes.
Você pode falar muito sobre as desvantagens do nuclearenergia e sobre a "estranheza" da humanidade, que usa quase qualquer descoberta para destruir sua própria espécie. A descoberta do plutônio-239, que é capaz de participar de uma reação em cadeia nuclear, tornou possível usá-lo como fonte de energia pacífica. O urânio-235, que é um análogo do plutônio, é extremamente raro na Terra; é muito mais difícil separá-lo do minério de urânio do que obter plutônio.
A análise de radioisótopos de isótopos de elementos radioativos dá uma ideia mais precisa do tempo de vida de uma amostra particular.
Usando a cadeia de transformação de urânio-tório,contida na crosta terrestre, permite determinar a idade do nosso planeta. A proporção da porcentagem desses elementos em média em toda a crosta terrestre constitui a base desse método. De acordo com os dados mais recentes, a idade da Terra é de 4,6 bilhões de anos.


























