
V nasledujúcom článku sa hovorí o atómea jeho štruktúra: ako sa objavilo, ako sa teória vyvinula v ich mysliach a počas experimentov, mysliteľov a vedcov. Kvantovo-mechanický model atómu ako najmodernejšieho dnes najviac popisuje jeho správanie a častice, ktoré tvoria zloženie. Prečítajte si o nej a jej funkciách nižšie.

Chemicky nedeliteľná minimálna časťChemický prvok so súborom charakteristických vlastností je atóm. Zahŕňa elektróny a jadro, ktoré zase obsahuje pozitívne nabité protóny a nenabité neutróny. Ak obsahuje rovnaký počet protónov a elektrónov, atóm samotný bude elektricky neutrálny. V opačnom prípade má poplatok: kladný alebo záporný. Potom sa atóm nazýva ión. Uskutočňuje sa ich klasifikácia: chemický prvok je určený počtom protónov a jeho izotopom neutrónmi. Atómy sa viažu na základe interatomických väzieb a tvoria molekuly.
Prvýkrát staroindické astarogrécki filozofi. A v období sedemnásteho a osemnásteho storočia túto myšlienku potvrdili chemici, ktorí experimentálne dokázali, že niektoré látky nemožno chemickými experimentmi rozdeliť na ich základné prvky. Od konca devätnásteho do začiatku dvadsiateho storočia však fyzici objavili subatomárne častice, čím bolo jasné, že atóm nie je nedeliteľný. V roku 1860 chemici sformulovali pojmy atóm a molekula, kde sa atóm stal najmenšou časticou prvku, ktorý bol súčasťou jednoduchých aj zložitých látok.

Tento model je vývojom predchádzajúceho.Kvantovo-mechanický model atómu predpokladá, že jadro atómu obsahuje neutróny bez náboja a kladne nabité protóny. Okolo neho sa nachádzajú záporne nabité elektróny. Ale podľa kvantovej mechaniky sa elektróny nepohybujú po vopred určených určitých trajektóriách. Napríklad v roku 1927 W. Heisenberg vyslovil princíp neurčitosti, podľa ktorého sa zdá nemožné presne určiť súradnice častice a jej rýchlosť alebo hybnosť.
Chemické vlastnosti elektrónov sú určené ichškrupina. V periodickej tabuľke sú atómy usporiadané podľa elektrických nábojov jadier (hovoríme o počte protónov), pričom neutróny neovplyvňujú chemické vlastnosti. Kvantovo-mechanický model atómu dokázal, že jeho hlavná hmotnosť dopadá na jadro, pričom podiel elektrónov zostáva zanedbateľný. Meria sa v jednotkách atómovej hmotnosti, čo sa rovná 1/12 hmotnosti atómu izotopu uhlíka C12.

Podľa V.Heisentberga nemožno s absolútnou istotou hovoriť o tom, že elektrón, ktorý má určitú rýchlosť, je v určitom bode priestoru. Na opis vlastností elektrónov sa používa vlnová funkcia psi.
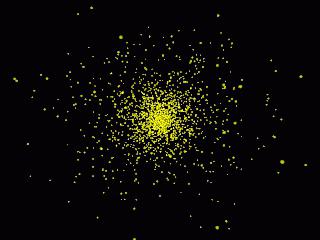
Pravdepodobnosť detekcie častice v konkrétnomčas je priamo úmerný druhej mocnine jeho modulu, ktorý sa počíta pre konkrétny čas. Psi na druhú sa nazýva hustota pravdepodobnosti, ktorá charakterizuje elektróny okolo jadra vo forme elektrónového oblaku. Čím je väčšia, tým vyššia je pravdepodobnosť výskytu elektrónu v určitom priestore atómu.
Pre lepšie pochopenie si môžete predstaviťsuperponované fotografie jedna na druhej, kde sú polohy elektrónu fixované v rôznych časoch. V mieste, kde je viac bodov a oblak bude najhustejší a pravdepodobnosť nájdenia elektrónu je najvyššia.
Vypočítalo sa napríklad, že kvantovo-mechanický model atómu vodíka zahŕňa najvyššiu hustotu elektrónového mraku umiestneného vo vzdialenosti 0,053 nanometrov od jadra.
Orbit z klasickej mechaniky nahradenýkvantový elektrónový oblak. Vlnová funkcia elektrónu psi sa tu nazýva orbitál, ktorý je charakterizovaný tvarom a energiou elektrónového oblaku vo vesmíre. Pri aplikácii na atóm máme na mysli priestor okolo jadra, v ktorom sa s najväčšou pravdepodobnosťou nachádza elektrón.

Rovnako ako zvyšok teórie, kvantový mechanický modelštruktúra atómu spôsobila skutočnú revolúciu vo vedeckom svete a medzi obyvateľmi. V skutočnosti je dodnes ťažké si predstaviť, že tá istá častica v rovnakom časovom okamihu môže byť súčasne nie na jednom, ale na rôznych miestach! Na obranu zavedených štruktúr hovoria, že v mikrokozme sa dejú udalosti, ktoré sú nepredstaviteľné a v makrokozme také nie sú. Ale je to naozaj tak? Alebo sa ľudia jednoducho boja čo i len pripustiť možnosť, že „kvapka je ako oceán a oceán je ako kvapka“?


























