
Фраза «озоновый слой», ставшая известной в 70-е dvojročným minulého storočia, je už dávno na okraji. Zároveň málokto skutočne rozumie, čo tento pojem znamená a aké nebezpečné je ničenie ozónovej vrstvy. Ešte väčším tajomstvom pre mnohých je štruktúra molekuly ozónu a v skutočnosti priamo súvisí s problémami ozónovej vrstvy. Dozvieme sa viac o ozóne, jeho štruktúre a priemyselných aplikáciách.
Ozón, alebo, ako sa nazýva aj aktívny kyslík, je azúrový plyn so štipľavým kovovým zápachom.

Táto látka môže existovať vo všetkých troch stavoch agregácie: plynná, tuhá a tekutá.
Zároveň sa v prírode nachádza ozón iba vo forme plynu, ktorý tvorí takzvanú ozónovú vrstvu. Obloha sa javí ako modrá v dôsledku svojej azúrovej farby.
Ozón dostal prezývku „aktívny kyslík“kvôli svojej podobnosti s kyslíkom. Hlavným aktívnym chemickým prvkom v týchto látkach je kyslík (O). Ak však molekula kyslíka obsahuje 2 jej atómy, potom molekula ozónu (vzorec - O3) pozostáva z 3 atómov tohto prvku.
Vďaka tejto štruktúre sú vlastnosti ozónu podobné vlastnostiam kyslíka, ale výraznejšie. Najmä ako O2, O SPOLOČNOSTI3 je najsilnejšie oxidačné činidlo.
Najdôležitejší rozdiel medzi týmito „súvisiacimi“látky, ktoré si každý musí pamätať, sú nasledujúce: ozón sa nedýcha, je toxický a pri vdýchnutí môže poškodiť pľúca alebo dokonca zabiť človeka. Navyše O3 ideálne na čistenie vzduchu od toxických nečistôt. Mimochodom, práve z tohto dôvodu je ľahké dýchať po daždi: ozón oxiduje škodlivé látky obsiahnuté vo vzduchu a čistí sa.
Model molekuly ozónu (zložený z 3 atómovkyslík) je trochu ako obrázok uhla a jeho veľkosť je 117 °. Táto molekula nemá nepárové elektróny, preto je diamagnetická. Okrem toho má polaritu, hoci sa skladá z atómov jedného prvku.
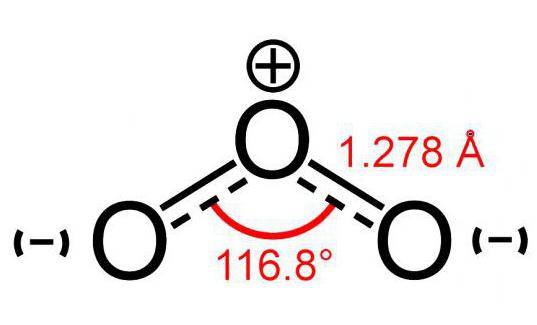
Dva atómy tejto molekuly sú navzájom pevne spojenéseba. Ale spojenie s tretím je menej spoľahlivé. Z tohto dôvodu je molekula ozónu (fotografia modelu je uvedená nižšie) veľmi krehká a rozkladá sa krátko po vzniku. Spravidla platí pre každú reakciu rozpadu O3 uvoľňuje sa kyslík.
Kvôli nestabilite ozónu je nemožné ho zaobstarať a uskladniť, ako aj prepraviť ako iné látky. Z tohto dôvodu je jeho výroba nákladnejšia ako iné látky.
Zároveň vysoká aktivita O3 umožňuje tejto látke byť najsilnejším oxidačným činidlom, silnejším ako kyslík a bezpečnejším ako chlór.
Ak je molekula ozónu zničená a O2, táto reakcia je vždy sprevádzaná uvoľňovaním energie. Zároveň musí dôjsť k opačnému procesu (tvorba O3 od asi2), je potrebné ich minimálne minúť.
V plynnom stave molekula ozónurozkladá sa pri 70 ° C Ak sa zvýši na 100 stupňov alebo viac, reakcia sa výrazne zrýchli. Prítomnosť nečistôt tiež urýchľuje obdobie rozpadu molekúl ozónu.
Nech je ozón akýkoľvek z týchto troch stavov, zachováva si svoju modrú farbu. Čím je hmota tvrdšia, tým je tento odtieň sýtejší a tmavší.

Každá molekula ozónu váži 48 g / mol. Je ťažší ako vzduch, čo pomáha separovať tieto látky medzi sebou.
ach3 schopný oxidovať takmer všetky kovy a nekovy (okrem zlata, irídia a platiny).
Táto látka sa tiež môže podieľať na spaľovacej reakcii, ale vyžaduje to vyššiu teplotu ako pre O2.
Ozón je schopný sa rozpustiť v H2O a freony. V tekutom stave sa môže miešať s kvapalným kyslíkom, dusíkom, metánom, argónom, tetrachlórmetánom a oxidom uhličitým.
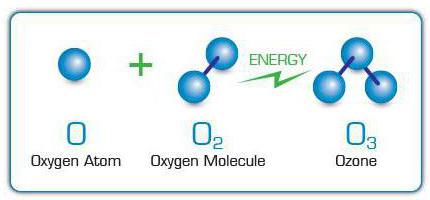
Molekuly O3 vznikajú pripojením voľných atómov kyslíka k molekulám kyslíka. Tie sa zase objavujú v dôsledku štiepenia ďalších molekúl O2 v dôsledku dopadu elektrických výbojov na ne,ultrafialové lúče, rýchle elektróny a ďalšie vysokoenergetické častice. Z tohto dôvodu je špecifický zápach ozónu cítiť v blízkosti šumivých elektrických spotrebičov alebo žiaroviek vyžarujúcich ultrafialové svetlo.

V priemyselnom meradle O3 emitované pomocou elektrických generátorov ozónu alebo ozonizátorov. V týchto zariadeniach prechádza elektrický prúd vysokého napätia prúdom plynu, v ktorom O2, ktorého atómy slúžia ako „stavebný materiál“ pre ozón.
Do týchto zariadení sa niekedy prečerpáva čistý kyslík alebo obyčajný vzduch. Kvalita výsledného ozónu závisí od čistoty východiskového produktu. Takže lekárske O3, určený na ošetrenie rán, sa extrahuje iba z chemicky čistého O2.
Po zistení, ako molekula ozónu vyzerá a ako sa formuje, stojí za to oboznámiť sa s históriou tejto látky.
Prvýkrát ho syntetizovali Holanďaniabádateľ Martin Van Marum v druhej polovici 18. storočia. Vedec si všimol, že po prechode elektrických iskier cez nádobu so vzduchom zmenil plyn v nej svoje vlastnosti. Van Marum zároveň nechápal, že izoloval molekuly novej látky.
A tu je jeho nemecký kolega menom Scheinbein, ktorý sa snaží rozložiť H2O na N a O2, upozornil na uvoľnenie nového plynu s prenikavým zápachom. Po rozsiahlom výskume vedec opísal látku, ktorú objavil, a na počesť gréckeho slova „vôňa“ jej dal meno „ozón“.
Schopnosť ničiť huby a baktérie, ako aj znižovať toxicitu škodlivých zlúčenín, ktoré otvorená látka mala, zaujala mnohých vedcov. 17 rokov po oficiálnom otvorení O3 Prvý navrhol Werner von Siemenszariadenie, ktoré umožňuje syntetizovať ozón v akomkoľvek množstve. A o 39 rokov neskôr geniálny Nikola Tesla vynašiel a patentoval prvý generátor ozónu na svete.
Bolo to toto zariadenie, už o 2 roky neskôr, prvýkrátpoužívané vo Francúzsku v úpravniach pitnej vody. So začiatkom XX storočia. Európa začína preorientovať sa na ozonizáciu pitnej vody.
Ruské impérium prvýkrát použilo túto techniku v roku 1911 a o 5 rokov neskôr boli v krajine vybavené takmer 4 desiatky zariadení na čistenie pitnej vody pomocou ozónu.
V súčasnosti ozonizácia vody postupne nahrádza chlórovanie. 95% všetkej pitnej vody v Európe sa teda čistí pomocou O3... Táto technika je veľmi populárna aj v USA. V CIS sa stále študuje, pretože aj keď je tento postup bezpečnejší a pohodlnejší, je nákladnejší ako chlórovanie.
Okrem čistenia vody, Oh3 má množstvo ďalších oblastí použitia.
Vo vzdialenosti 15 - 35 km nad zemským povrchom sa nachádza ozónová vrstva, alebo ako sa tiež nazýva ozonosféra. Na tomto mieste sa koncentruje O3 slúži ako druh filtra pre škodlivé slnečné žiarenie.
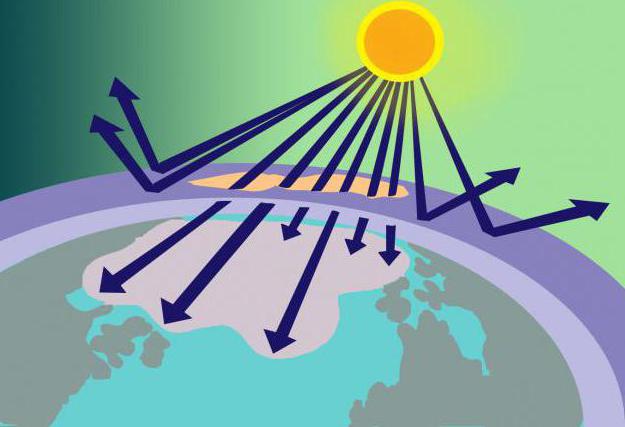
Odkiaľ pochádza toto množstvo látky, aksú jeho molekuly nestabilné? Odpoveď na túto otázku nie je zložitá, ak si pripomenieme model molekuly ozónu a spôsob jeho vzniku. Takže kyslík pozostávajúci z 2 molekúl kyslíka, ktorý sa dostáva do stratosféry, je tam zahrievaný slnečnými lúčmi. Ukázalo sa, že táto energia je dostatočná na rozdelenie O2 na atómy, z ktorých O3... Ozónová vrstva zároveň využíva nielen časť slnečnej energie, ale ju aj filtruje, absorbuje nebezpečné ultrafialové svetlo.
Vyššie bolo povedané, že ozón je rozpustený freónmi.Tieto plynné látky (používané pri výrobe dezodorantov, hasiacich prístrojov a chladničiek), ktoré sa raz dostanú do atmosféry, ovplyvňujú ozón a prispievajú k jeho rozkladu. Vďaka tomu sa v ozonosfére objavujú otvory, cez ktoré sa na planétu dostávajú nefiltrované slnečné lúče, ktoré deštruktívne ovplyvňujú živé organizmy.
Po zvážení vlastností a štruktúry molekúl ozónu možno dospieť k záveru, že táto látka, aj keď je nebezpečná, je pre ľudstvo veľmi užitočná, ak sa používa správne.


























