
แอมโมเนีย - ไฮโดรเจนไนไตรด์ - หนึ่งในสารประกอบที่สำคัญที่สุดของไนโตรเจนและไฮโดรเจน เป็นก๊าซที่ปราศจากสี แต่มีกลิ่นฉุน องค์ประกอบทางเคมีสะท้อนถึงสูตรของแอมโมเนีย - NH3. เพิ่มความดันหรือลดอุณหภูมิสารที่นำไปสู่การเปลี่ยนเป็นของเหลวไม่มีสี ก๊าซแอมโมเนียและสารละลายของมันถูกนำมาใช้กันอย่างแพร่หลายในอุตสาหกรรมและการเกษตร ในทางการแพทย์ใช้แอมโมเนียมไฮดรอกไซด์ 10% - แอมโมเนีย
โมเลกุลไฮโดรเจนไนไตรด์มีรูปร่างเหมือนพีระมิดที่ฐานของไนโตรเจนถูกยึดกับอะตอมไฮโดรเจนสามตัว พันธบัตรของ N - H เป็นโพลาไรซ์ที่รุนแรง ไนโตรเจนดูดซับคู่อิเล็กตรอน ดังนั้นค่าลบสะสมอยู่ที่อะตอม N ซึ่งเป็นค่าบวกจะมีสมาธิกับไฮโดรเจน ความคิดของกระบวนการนี้ได้มาจากรูปแบบของโมเลกุลสูตรอิเล็กทรอนิกส์และโครงสร้างของแอมโมเนีย

Нитрид водорода очень хорошо растворяется в воде (700: 1 ที่ 20 ° C) การปรากฏตัวของโปรตรอนฟรีจะนำไปสู่การสร้างไฮโดรเจน "สะพาน" จำนวนมากที่เชื่อมต่อโมเลกุลกับแต่ละอื่น ๆ คุณสมบัติของโครงสร้างและพันธะเคมียังนำไปสู่ความจริงที่ว่าแอมโมเนียจะถูกทำให้เป็นของเหลวได้ง่ายโดยการเพิ่มความดันหรือลดอุณหภูมิ (-33 องศาเซลเซียส)

คำว่า "แอมโมเนีย" ถูกนำมาใช้ในการใช้วิทยาศาสตร์1801 ตามคำแนะนำของนักเคมีชาวรัสเซีย J. Zakharov แต่เนื้อหาของมนุษยชาติคุ้นเคยจากสมัยโบราณลึก แก๊สที่มีกลิ่นฉุนจะถูกปล่อยออกมาเมื่อถูกเน่าเสียของเสียสารอินทรีย์หลายชนิดเช่นโปรตีนและยูเรียระหว่างการสลายตัวของเกลือแอมโมเนียม นักประวัติศาสตร์ด้านเคมีเชื่อว่าสารนี้ได้รับการตั้งชื่อเพื่อเป็นเกียรติแก่พระเจ้าอียิปต์โบราณ Amon ในแอฟริกาเหนือมีโอเอซิสแห่ง Siwa (Ammon) ล้อมรอบด้วยทะเลทรายลิเบียมีซากปรักหักพังของเมืองโบราณและวัดอยู่ติดกับที่มีเงินฝากของแอมโมเนียมคลอไรด์ สารนี้ในยุโรปเรียกว่า "เกลือของอานนท์" มีตำนานเล่าว่าชาวโอเอซิสแห่ง Siwa สูดกลิ่นเกลือในพระวิหาร
นักฟิสิกส์และนักเคมีชาวอังกฤษ R.ในการทดลอง Boyle เผามูลสัตว์และสังเกตการก่อตัวของควันสีขาวบนไม้ไผ่ที่จุ่มลงในกรดไฮโดรคลอริกและนำเข้าสู่กระแสของแก๊สที่เกิด ในปี ค.ศ. 1774 นักเคมีชาวอังกฤษอีกคน D. Priestley ได้ให้แอมโมเนียมคลอไรด์กับแอลกอฮอลล์และปล่อยสารออกไซด์ พรีสเรียกสารประกอบ "alkaline air" เนื่องจากสารละลายของมันแสดงคุณสมบัติของฐานอ่อนแอ ประสบการณ์ของ Boyle ที่แอมโมเนียทำปฏิกิริยากับกรดไฮโดรคลอริกได้อธิบายไว้ แอมโมเนียมคลอไรด์สีขาวเกิดขึ้นเมื่อโมเลกุลของสารตัวทำปฏิกิริยาสัมผัสโดยตรงกับอากาศ

Химическая формула аммиака была установлена в 1875 โดยชาวฝรั่งเศส K. Berthollet ผู้ดำเนินการทดลองเกี่ยวกับการสลายตัวของสารเข้าไปในส่วนประกอบของส่วนประกอบภายใต้การกระทำของการปลดปล่อยไฟฟ้า จนถึงขณะนี้การทดลองของ Priestley, Boyle และ Berthollet ได้ถูกทำซ้ำในห้องทดลองสำหรับการผลิตไฮโดรเจนไนไตรด์และแอมโมเนียมคลอไรด์ วิธีการทางอุตสาหกรรมได้รับการพัฒนาโดย A. Le Chatelier ในปี 1901 ซึ่งได้รับสิทธิบัตรสำหรับวิธีการสังเคราะห์สารจากไนโตรเจนและไฮโดรเจน

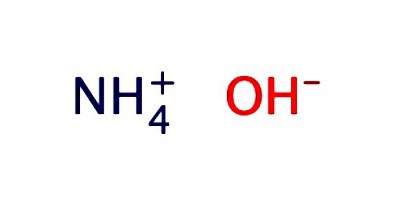
สารละลายแอมโมเนียในน้ำมักจะถูกบันทึกในรูปของไฮดรอกไซด์ - NH4OH มันแสดงคุณสมบัติของด่างอ่อน:
ความสมดุลในปฏิกิริยาของปฏิสัมพันธ์ของแอมโมเนียกับน้ำจะเปลี่ยนไปสู่สารเดิม ไฮโดรเจนไนไตรด์ที่เตรียมไว้ล่วงหน้าจะเผาไหม้ได้ดีในออกซิเจน ไนโตรเจนออกซิไดซ์เป็นโมเลกุลไดอะตอมของสาร N2 ตัวง่าย แอมโมเนียยังมีคุณสมบัติในการลดการเกิดปฏิกิริยากับทองแดง (II) ออกไซด์

ไนไตรด์ไฮโดรเจนใช้ในการผลิตเกลือแอมโมเนียมและกรดไนตริกซึ่งเป็นหนึ่งในผลิตภัณฑ์ที่สำคัญที่สุดของอุตสาหกรรมเคมี แอมโมเนียถูกใช้เป็นวัตถุดิบในการผลิตโซดา (โดยวิธีไนเตรต) เนื้อหาของไฮโดรเจนไนไตรด์ในสารละลายเข้มข้นในภาคอุตสาหกรรมถึง 25% ในการเกษตรใช้สารละลายแอมโมเนีย สูตรปุ๋ยของเหลว - NH4OHสารจะใช้โดยตรงในรูปแบบของการแต่งกายด้านบน วิธีอื่น ๆ เพื่อเพิ่มดินด้วยไนโตรเจนคือการใช้เกลือแอมโมเนียม: ไนเตรตคลอไรด์ฟอสฟอรัส ในสภาพอุตสาหกรรมและสถานที่ทำการเกษตรไม่ควรจัดเก็บปุ๋ยแร่ธาตุที่มีเกลือแอมโมเนียมกับด่าง เมื่อความสมบูรณ์ของบรรจุภัณฑ์ถูกทำลายสารสามารถทำปฏิกิริยากับแต่ละอื่น ๆ เพื่อสร้างแอมโมเนียและปล่อยลงในอากาศภายในอาคาร สารประกอบเป็นพิษส่งผลเสียต่อระบบทางเดินหายใจระบบประสาทส่วนกลางของมนุษย์ ส่วนผสมของแอมโมเนียและอากาศจะระเบิดได้


























