
Χαρακτηριστικά της δομής του ακετυλενίου επηρεάζουν τις ιδιότητες, την παραγωγή και τη χρήση του. Το σύμβολο της σύνθεσης της ουσίας - C2H2 - Αυτός είναι ο πιο απλός και ακαθάριστος τύπος.Το ακετυλένιο σχηματίζεται από δύο άτομα άνθρακα, μεταξύ των οποίων συμβαίνει ένας τριπλός δεσμός. Η παρουσία του αντικατοπτρίζει τους διάφορους τύπους τύπων και μοντέλων του μορίου αιθίνης, που καθιστούν δυνατή την κατανόηση του προβλήματος της επίδρασης μιας δομής στις ιδιότητες μιας ουσίας.
Углеводороды алкины, или ацетиленовые, являются ακυκλικό, ακόρεστο. Η αλυσίδα των ατόμων άνθρακα δεν είναι κλειστή, περιέχει απλούς και πολλαπλούς δεσμούς. Η σύνθεση αλκινών αντικατοπτρίζει τον σύνθετο τύπο CΚ.Χ2n - 2. Στα μόρια των ουσιών της κατηγορίας αυτής υπάρχειέναν ή περισσότερους τριπλούς δεσμούς. Οι ενώσεις ακετυλενίου είναι ακόρεστες. Αυτό σημαίνει ότι μόνο ένα σθένος άνθρακα οφείλεται στο υδρογόνο. Οι υπόλοιποι τρεις δεσμοί χρησιμοποιούνται στην αλληλεπίδραση με άλλα άτομα άνθρακα.
Ο πρώτος - και ο πιο διάσημος εκπρόσωποςαλκύνια - ακετυλένιο ή αιθίνη. Το ασήμαντο όνομα της ουσίας προέρχεται από τη λατινική λέξη "acetum" - "ξίδι" και το ελληνικό - "hyle" - "δέντρο". Ο πρόγονος της ομόλογης σειράς ανακαλύφθηκε το 1836 σε χημικά πειράματα, αργότερα η ουσία συντέθηκε από άνθρακα και υδρογόνο από τους E. Devi και M. Berthelot (1862). Σε συνηθισμένη θερμοκρασία και κανονική ατμοσφαιρική πίεση, το ακετυλένιο βρίσκεται σε αέρια κατάσταση. Είναι άχρωμο αέριο, άοσμο, ελάχιστα διαλυτό στο νερό. Το Etin διαλύεται ευκολότερα σε αιθανόλη και ακετόνη.

Το Etin είναι το απλούστερο μέλος της ομόλογης σειράς του, η σύνθεση και η δομή του αντικατοπτρίζουν τους τύπους:
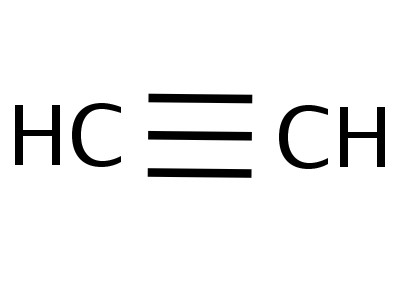
Οι τύποι που δείχνουν την κατανομή των ηλεκτρονίων,χρησίμευσε ως βάση για τη δημιουργία μοντέλων ατομικής τροχιάς, χωρικών τύπων μορίων (στερεοχημικών). Στα τέλη του 18ου αιώνα, τα μοντέλα ρουλεμάν έγιναν ευρέως διαδεδομένα - για παράδειγμα, μπάλες διαφορετικών χρωμάτων και μεγεθών, που υποδηλώνουν άνθρακα και υδρογόνο, τα οποία σχηματίζουν ακετυλένιο. Ο δομικός τύπος του μορίου παρουσιάζεται με τη μορφή ράβδων, συμβολίζοντας τους χημικούς δεσμούς και τον αριθμό τους σε κάθε άτομο.
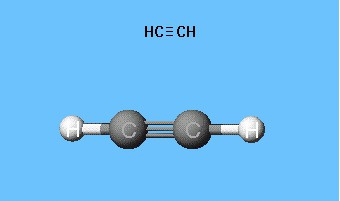
Το μοντέλο κυλίνδρου ακετυλενίου αναπαράγεταιγωνίες δεσμού ίσες προς 180 °, αλλά οι πυρηνικές αποστάσεις στο μόριο αποτυπώνονται περίπου. Τα κενά μεταξύ των μπαλών δεν δημιουργούν μια ιδέα για την πλήρωση του χώρου των ατόμων με πυκνότητα ηλεκτρονίων. Το μειονέκτημα εξαλείφεται στα μοντέλα Dreyding, τα οποία ορίζουν τους πυρήνες των ατόμων όχι από τις σφαίρες, αλλά από τα σημεία σύνδεσης των ράβδων μεταξύ τους. Τα σύγχρονα ογκομετρικά μοντέλα δίνουν μια πιο ζωντανή ιδέα των ατομικών και μοριακών τροχιακών.
Ο άνθρακας στην διεγερμένη κατάσταση περιέχει τρία p τροχιακά και ένα s με μη συζευγμένα ηλεκτρόνια. Στο σχηματισμό μεθανίου (CH4) εμπλέκονται στη δημιουργία ίσης αξίαςδεσμούς με άτομα υδρογόνου. Ο διάσημος Αμερικανός ερευνητής L. Pauling ανέπτυξε τη θεωρία της υβριδικής κατάστασης των ατομικών τροχιακών (AO). Η εξήγηση της συμπεριφοράς του άνθρακα στις χημικές αντιδράσεις είναι η ευθυγράμμιση του ΑΟ στο σχήμα και στην ενέργεια, στον σχηματισμό νέων σύννεφων. Τα υβριδικά τροχιακά δίνουν ισχυρότερες συνδέσεις, ο τύπος γίνεται πιο σταθερός.
Τα άτομα άνθρακα στο μόριο ακετυλενίου, σε αντίθεση με τοτο μεθάνιο υφίσταται sp-υβριδισμό. Σχήματα και ενεργειακά μείγματα s- και p ηλεκτρονίων. Δύο τροχιακά σχήματα εμφανίζονται υπό γωνία 180 °, που κατευθύνεται σε αντίθετες πλευρές του πυρήνα.

Σε αέρια υβριδικά αέρια ακετυλενίουσυμμετέχουν στη δημιουργία σ-δεσμών με τα ίδια γειτονικά άτομα και με υδρογόνο σε ζεύγη C-H. Δύο μη-υβριδικά ρ-τροχιακά κάθετα μεταξύ τους παραμένουν. Στο μόριο της αιθίνης, εμπλέκονται στο σχηματισμό δύο π-δεσμών. Μαζί με σ, δημιουργείται ένας τριπλός δεσμός, ο οποίος αντικατοπτρίζεται από τον δομικό τύπο. Το ακετυλένιο διαφέρει από το αιθάνιο και το αιθυλένιο από την απόσταση μεταξύ των ατόμων. Ο τριπλός δεσμός είναι μικρότερος από τον διπλό, αλλά έχει ένα μεγάλο αποθέμα ενέργειας, είναι πιο ανθεκτικό. Η μέγιστη πυκνότητα σ- και π-δεσμών βρίσκεται σε κάθετες περιοχές, γεγονός που οδηγεί στο σχηματισμό κυλινδρικού νέφους ηλεκτρονίων.
Το μόριο του αιθίου έχει γραμμική μορφή, η οποία είναι επιτυχήςαντανακλά τον χημικό τύπο ακετυλενίου-Η-C = C-Η. Τα άτομα άνθρακα και υδρογόνου είναι κατά μήκος μιας ευθείας γραμμής, 3 σ- και 2 π-δεσμοί προκύπτουν μεταξύ τους. Η ελεύθερη κίνηση, η περιστροφή κατά μήκος του άξονα C - C είναι αδύνατη, γεγονός που εμποδίζεται από την ύπαρξη πολλαπλών δεσμών. Άλλα χαρακτηριστικά τριπλών δεσμών:
Για σύγκριση, στα μόρια αιθανίου και αιθυλενίου, το μήκος των απλών και διπλών χημικών δεσμών είναι 1,54 και 1,34 nm, αντίστοιχα, η ενέργεια ρήξης C-C είναι 348 kJ / mol, το C = C είναι 614 kJ / mol.

Το ακετυλένιο είναι ο απλούστερος αντιπρόσωπος των αλκυνών των οποίων τα μόρια έχουν επίσης έναν τριπλό δεσμό. Προφήτης CH3Το C≡CH είναι ένα ομόλογο του ακετυλενίου. Ο τύπος του τρίτου αντιπροσωπευτικού αλκυλο-βουτυν-1-CH3CH2С≡СН. Το ακετυλένιο είναι το ασήμαντο όνομα για την αιθίνη. Η συστηματική ονοματολογία των αλκυνών υπόκειται στους κανόνες της IUPAC:

Το Etin και το προπύνιο δεν έχουν τριπλά ισομερήσυνδέσεις, εμφανίζονται, ξεκινώντας από το butin Τα ισομερή ανθρακικού σκελετού της πεντίνης και τα ακόλουθα ομόλογα. Όσον αφορά τον τριπλό δεσμό, δεν εμφανίζεται το χωρικό ισομερισμό των ακετυλενικών υδρογονανθράκων.
Τα πρώτα 4 ομόλογα της αιθίνης είναι αέρια που είναι ελάχιστα διαλυτά στο νερό. Υδρογονάνθρακες ακετυλενίου Γ5 - Γ15 - υγρά. Τα στερεά είναι ομόλογα αιθίνης, ξεκινώντας με υδρογονάνθρακα C17. Η χημική φύση των αλκυνίων βιώνεισημαντική επίδραση τριπλών δεσμών. Οι υδρογονάνθρακες αυτού του τύπου είναι πιο δραστικοί από το αιθυλένιο, συνδέουν διάφορα σωματίδια. Αυτή η ιδιότητα βασίζεται στην ευρεία χρήση της αιθίνης στη βιομηχανία και την τεχνολογία. Όταν καίγεται το ακετυλένιο, απελευθερώνεται μεγάλη ποσότητα θερμότητας, η οποία χρησιμοποιείται στην κοπή αερίων και στη συγκόλληση μετάλλων.


























