
Αμμωνία - νιτρίδιο υδρογόνου - μία από τις σημαντικότερες ενώσεις του αζώτου και του υδρογόνου. Πρόκειται για αέριο χωρίς χρώμα, αλλά με πικρή μυρωδιά. Η χημική σύνθεση αντανακλά τον τύπο της αμμωνίας - ΝΗ3. Αυξάνοντας την πίεση ή μειώνοντας τη θερμοκρασίαουσία οδηγεί στη μετατροπή του σε ένα άχρωμο υγρό. Η αέρια αμμωνία και τα διαλύματα της χρησιμοποιούνται ευρέως στη βιομηχανία και τη γεωργία. Στην ιατρική χρησιμοποιείται 10% υδροξείδιο του αμμωνίου - αμμωνία.
Молекула нитрида водорода по форме напоминает μια πυραμίδα, στη βάση της οποίας υπάρχει άζωτο, συνδεδεμένη με τρία άτομα υδρογόνου. Οι δεσμοί Ν-Η είναι έντονα πολωμένοι. Το άζωτο προσελκύει περισσότερο το ζεύγος ηλεκτρονίων δέσμευσης. Επομένως, το αρνητικό φορτίο συσσωρεύεται στα άτομα Ν, το θετικό φορτίο συμπυκνώνεται σε υδρογόνο. Το μοντέλο του μορίου, ο ηλεκτρονικός και δομικός τύπος της αμμωνίας, δίνει μια ιδέα αυτής της διαδικασίας.

Το νιτρίδιο του υδρογόνου διαλύεται πολύ καλά στο νερό(700: 1 στους 20 ° C). Η παρουσία πρακτικά ελεύθερων πρωτονίων οδηγεί στο σχηματισμό πολυάριθμων «γεφυρών» υδρογόνου που συνδέουν τα μόρια μαζί. Χαρακτηριστικά της δομής και της χημικής συγκόλλησης οδηγούν επίσης στο γεγονός ότι η αμμωνία υγροποιείται εύκολα με την αύξηση της πίεσης ή με τη μείωση της θερμοκρασίας (-33 ° C).

Термин «аммиак» был введен в научный обиход в 1801 κατά την εισήγηση του ρώσικου χημικού Ya. Zakharov, αλλά η ουσία της ανθρωπότητας είναι γνωστή από την αρχαιότητα. Ένα αέριο με έντονη οσμή απελευθερώνεται όταν αποσυντίθεται τα προϊόντα ζωτικής δραστηριότητας, πολλές οργανικές ενώσεις, για παράδειγμα, πρωτεΐνες και ουρία, κατά τη διάρκεια της αποσύνθεσης των αλάτων αμμωνίου. Οι ιστορικοί της χημείας πιστεύουν ότι η ουσία πήρε το όνομά της από τον αρχαίο Αιγύπτιο θεό Amun. Στη Βόρεια Αφρική υπάρχει μια όαση Siwa (Αμμών). Περιτριγυρισμένο από την έρημο της Λιβύης, υπάρχουν ερείπια αρχαίας πόλης και ναός, δίπλα από τα οποία υπάρχουν αποθέσεις χλωριούχου αμμωνίου. Αυτή η ουσία στην Ευρώπη ονομάστηκε "άλας αμμωνίου". Υπάρχει μια παράδοση ότι οι κάτοικοι της όασης Siwa ψεκάσουν αλάτι στο ναό.
Αγγλικός φυσικός και χημικός R.Ο Boyle σε πειράματα καίγεται κοπριά και παρατηρεί το σχηματισμό λευκού καπνού πάνω σε ένα ραβδί που έχει υγρανθεί με υδροχλωρικό οξύ και εισάγεται στον πίδακα του προκύπτοντος αερίου. Το 1774 ένας άλλος Βρετανός χημικός, ο D. Priestley, θερμαίνει χλωριούχο αμμώνιο με ένυδρη ασβέστη και διαχωρίζει την αέρια ουσία. Ο Priestley ονομάζεται ένωση "αλκαλικός αέρας", επειδή η λύση του έδειξε τις ιδιότητες μιας ασθενούς βάσης. Το πείραμα Boyle, στο οποίο αντέδρασε η αμμωνία με υδροχλωρικό οξύ, εξηγήθηκε. Το στερεό χλωριούχο αμμώνιο λευκού χρώματος συμβαίνει όταν τα μόρια των αντιδρώντων ουσιών έρχονται σε επαφή απευθείας στον αέρα.

Ο χημικός τύπος αμμωνίας θεσπίστηκε στην1875 από τον Γάλλο K. Bertolle, ο οποίος διεξήγαγε ένα πείραμα για την αποσύνθεση της ύλης σε σύνθετα συστατικά υπό τη δράση μιας ηλεκτρικής εκφόρτισης. Μέχρι τώρα, τα πειράματα των Priestley, Boyle και Berthollet έχουν αναπαραχθεί σε εργαστήρια για την παραγωγή νιτριδίου υδρογόνου και χλωριούχου αμμωνίου. Η βιομηχανική μέθοδος αναπτύχθηκε το 1901 από τον A. Le Chatelier, ο οποίος έλαβε δίπλωμα ευρεσιτεχνίας για τη μέθοδο σύνθεσης της ύλης από το άζωτο και το υδρογόνο.

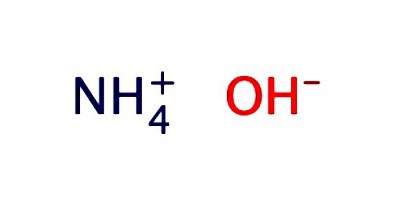
Ένα υδατικό διάλυμα αμμωνίας συνήθως καταγράφεται ως υδροξείδιο-ΝΗ4OH. Παρουσιάζει τις ιδιότητες ενός ασθενούς αλκαλίου:
Ισορροπία στην αντίδραση αμμωνίας μετο νερό μετατοπίζεται προς τις πρώτες ύλες. Το προθερμανθέν νιτρίδιο υδρογόνου καίει καλά στο οξυγόνο. Η οξείδωση του αζώτου συμβαίνει σε διατομικά μόρια απλής ύλης Ν2. Οι μειωτικές ιδιότητες της αμμωνίας εκδηλώνονται επίσης στην αντίδραση με οξείδιο του χαλκού (II).

Το νιτρίδιο του υδρογόνου χρησιμοποιείται στην παραγωγή αλατιού.αμμωνίου και νιτρικού οξέος - ένα από τα σημαντικότερα προϊόντα της χημικής βιομηχανίας. Η αμμωνία χρησιμοποιείται ως πρώτη ύλη για την παραγωγή σόδας (με τη μέθοδο των νιτρικών). Η περιεκτικότητα σε νιτρίδιο υδρογόνου σε βιομηχανικό συμπυκνωμένο διάλυμα φθάνει το 25%. Στη γεωργία, χρησιμοποιείται ένα υδατικό διάλυμα αμμωνίας. Υγρή φόρμουλα λιπασμάτων - NH4OH.Η ουσία χρησιμοποιείται άμεσα με τη μορφή επίδεσμου. Άλλοι τρόποι εμπλουτισμού του εδάφους με άζωτο είναι η χρήση αλάτων αμμωνίου: νιτρικά, χλωριούχα, φωσφορικά. Σε βιομηχανικές συνθήκες και σε γεωργικές εγκαταστάσεις δεν συνιστάται η αποθήκευση ορυκτών λιπασμάτων που περιέχουν άλατα αμμωνίου με αλκάλια. Όταν η ακεραιότητα της συσκευασίας υποβαθμίζεται, οι ουσίες μπορούν να αντιδρούν μεταξύ τους για να σχηματίσουν αμμωνία και να την απελευθερώσουν στον εσωτερικό αέρα. Η τοξική ένωση επηρεάζει δυσμενώς το αναπνευστικό σύστημα, το κεντρικό νευρικό σύστημα του ανθρώπου. Ένα μείγμα αμμωνίας και αέρα είναι εκρηκτικό.


























