
Povijest proučavanja radioaktivnosti započela je 1. ožujka1896., kada je slavni francuski znanstvenik Henri Becquerel slučajno otkrio neobičnost u emisiji uranovih soli. Pokazalo se da su fotografske ploče smještene u istom okviru s uzorkom osvijetljene. To je zbog neobičnog, jako prodirajućeg zračenja kojim je posjedovao uran. Ovo svojstvo pronađeno je u najtežim elementima koji ispunjavaju periodičnu tablicu. Dali su mu ime "radioaktivnost".
Taj je proces spontana transformacijaatoma izotopa nekog elementa u drugi izotop s istodobnim oslobađanjem elementarnih čestica (elektrona, jezgara helijevih atoma). Pokazalo se da je transformacija atoma spontana, da ne zahtijeva apsorpciju energije izvana. Glavna količina koja karakterizira proces oslobađanja energije tijekom raspada radioaktivnog zračenja naziva se aktivnošću.
A = λN, gdje je λ konstanta raspada, N je broj aktivnih atoma u uzorku.
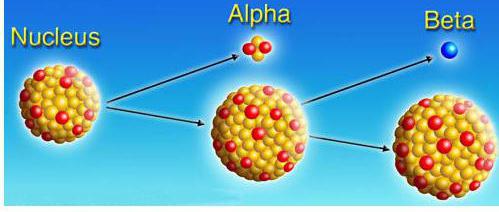
Rasporedi α, β, γ-raspad. Odgovarajuće jednadžbe nazivamo pravilima pomaka:
Ime | Što se događa | Jednadžba reakcije |
α - raspadanje | transformacija atomske jezgre X u jezgru Y oslobađanjem jezgre atoma helija | ZIX→Z-2YA-4+2On4 |
β - raspadanje | transformacija atomske jezgre X u jezgru Y s oslobađanjem elektrona | ZIX→Z + 1YI+-1eI |
γ - raspadanje | ne popraćeno promjenom jezgre, energija se oslobađa u obliku elektromagnetskog vala | ZXI→ZxI+ γ |
Nije moguće postaviti točku raspadanja česticaovog određenog atoma. Za njega je to više "nesreća" nego obrazac. Oslobađanje energije koje karakterizira ovaj proces definira se kao aktivnost uzorka.

Utvrđeno je da postoji vrijeme tijekomkoja se točno polovici atoma datog uzorka podvrgava raspadanju. Taj se vremenski interval naziva "poluvrijeme". Koja je svrha uvođenja ovog koncepta?
Čini se da je za vrijeme jednako razdobljutočno polovica svih aktivnih atoma u danom uzorku propada. Ali znači li to da će se u vremenu od dva poluvijeka svi aktivni atomi potpuno raspasti? Nikako. Nakon određenog trenutka, polovica radioaktivnih elemenata ostaje u uzorku, nakon istog vremenskog razdoblja propada još polovica preostalih atoma, i tako dalje. U tom slučaju zračenje traje dugo, znatno premašujući vrijeme poluraspada. To znači da su aktivni atomi sačuvani u uzorku bez obzira na zračenje
Vrijeme poluraspada vrijednost je koja ovisi isključivo o svojstvima određene tvari. Vrijednost količine utvrđena je za mnoge poznate radioaktivne izotope.
| ime | oznaka | Tip raspadanja | Pola zivota |
Radij | 88Ra219 | alfa | 0,001 sekunde |
magnezij | 12mg27 | beta | 10 minuta |
Radon | 86Rn222 | alfa | 3,8 dana |
Kobalt | 27Co60 | beta, gama | 5,3 godine |
Radij | 88Ra226 | alfa, gama | 1620 godina |
Uran | 92u238 | alfa, gama | 4,5 milijarde godina |
Završeno utvrđivanje poluživotaeksperimentalno. Tijekom laboratorijskih ispitivanja aktivnost se mjeri više puta. Budući da su laboratorijski uzorci minimalne veličine (sigurnost istraživača je najvažnija), pokus se izvodi u različitim vremenskim intervalima, ponavljajući se više puta. Temelji se na redovitosti promjena u aktivnosti tvari.
U svrhu određivanja poluvijekaaktivnost određenog uzorka mjeri se u određenim intervalima. Uzimajući u obzir činjenicu da je ovaj parametar povezan s brojem raspadnutih atoma, koristeći zakon radioaktivnog raspada, određuje se vrijeme poluraspada.

Neka je broj aktivnih elemenata istraženog izotopa u određenom vremenu N, vremenski interval tijekom kojeg je promatranje t2- t1, gdje su trenuci početka i kraja promatranja dovoljno blizu. Pretpostavimo da je n broj atoma koji propadaju u određenom vremenskom intervalu, tada je n = KN (t2- t1).
U ovom je izrazu K = 0,693 / T½ koeficijent proporcionalnosti, koji se naziva konstanta raspada. T½ je poluživot izotopa.
Uzmimo vremenski interval kao jedinicu. U ovom slučaju, K = n / N označava udio sadašnjih jezgri izotopa koji propadaju u jedinici vremena.
Poznavajući vrijednost konstante raspada, moguće je odrediti vrijeme poluraspada: T½ = 0,693 / K.
Iz toga proizlazi da se u jedinici vremena ne raspada određeni broj aktivnih atoma, već određeni njihov udio.
Vrijeme poluraspada je osnova za RRP.Uzorak su izveli Frederico Soddy i Ernest Rutherford na temelju rezultata eksperimentalnih studija 1903. godine. Iznenađujuće je da su višestruka mjerenja izvršena s uređajima daleko od savršenog, u uvjetima početka dvadesetog stoljeća, dovela do točnog i potkrijepljenog rezultata. Postao je osnova teorije radioaktivnosti. Izvedimo matematički zapis zakona radioaktivnog raspada.

- Neka N0 - broj aktivnih atoma u određenom trenutku. Nakon isteka vremenskog intervala t, N elemenata ostaje neraspadnuto.
- Do trenutka vremena jednakog poluvijeku, ostat će točno polovica aktivnih elemenata: N = N0/ 2.
- Nakon još jednog vremena poluraspada, uzorak ostaje: N = N0/ 4 = N0/ 22 aktivni atomi.
- Nakon vremena jednakog još jednom poluvijeku, uzorak zadržava samo: N = N0/ 8 = N0/ 23.
- Do trenutka kada prođe n poluvijeka, uzorak će imati N = N0/ 2n aktivne čestice. U ovom izrazu, n = t / T½: omjer vremena ispitivanja i poluvijeka.
- ZRR ima malo drugačiji matematički izraz, prikladniji za rješavanje problema: N = N02-t / T½.
Pravilnost vam omogućuje utvrđivanje, poredpoluvrijeme, broj atoma aktivnog izotopa koji se nisu raspadali u određeno vrijeme. Znajući broj atoma u uzorku na početku promatranja, nakon nekog vremena moguće je odrediti životni vijek datog pripravka.
Formula zakona radioaktivnog raspada pomaže odrediti vrijeme poluraspada samo uz prisustvo određenih parametara: broja aktivnih izotopa u uzorku, što je prilično teško doznati.
Formulu RRP moguće je zapisati koristeći koncepte aktivnosti i mase atoma lijeka.
Aktivnost je proporcionalna broju radioaktivnih atoma: A = A0• 2-t / T... U ovoj formuli A0 - aktivnost uzorka u početnom trenutku, A - aktivnost nakon t sekundi, T - vrijeme poluraspada.
Masa tvari može se koristiti na sljedeći način: m = m0• 2-t / T
Tijekom bilo kakvih jednakih intervala vremena, potpuno isti udio radioaktivnih atoma dostupan u danom pripravku propada.
Zakon je statistički u svakom smislu,definiranje procesa koji se odvijaju u mikrosvijetu. Jasno je da je vrijeme poluraspada radioaktivnih elemenata statistička vrijednost. Vjerojatnosna priroda događaja u atomskim jezgrama sugerira da se proizvoljna jezgra može raspasti u bilo kojem trenutku. Nemoguće je predvidjeti događaj; njegovu vjerojatnost možete odrediti samo u određenom trenutku. Kao posljedica toga, poluživot je besmislen:

Postojanje atoma u izvornikudržava može trajati sekundu, a možda i milijune godina. Također nije potrebno govoriti o životnom vijeku određene čestice. Uvodeći vrijednost jednaku prosječnoj vrijednosti životnog vijeka atoma, može se govoriti o postojanju atoma radioaktivnog izotopa, posljedicama radioaktivnog raspada. Poluvrijeme jezgre atoma ovisi o svojstvima datog atoma, a ne ovisi o ostalim količinama.
Je li moguće riješiti problem: kako pronaći poluvijek, znajući prosječno vrijeme života?
Utvrđivanje poluživota odnosa između prosječnog vijeka trajanja atoma i konstante raspada ne pomaže ništa manje.
τ = T1/2/ ln2 = T1/2/ 0,693 = 1 / λ.
U ovom je zapisu τ prosječni životni vijek, λ konstanta raspada.
Upotreba RRR za određivanje dobi pojedincaprimjerci su se raširili u istraživanjima krajem dvadesetog stoljeća. Točnost određivanja starosti fosilnih artefakata toliko se povećala da može dati predodžbu o vremenu života tisućljećima prije Krista.
Radiokarbonska analiza fosilnih organskihUzorci se temelje na promjenama u aktivnosti ugljika-14 (radioaktivnog izotopa ugljika) prisutnog u svim organizmima. U metabolizam ulazi u živi organizam i u njemu je sadržan u određenoj koncentraciji. Nakon smrti, metabolizam s okolinom prestaje. Koncentracija radioaktivnog ugljika smanjuje se prirodnim raspadom, aktivnost proporcionalno opada.
S vrijednošću poput poluživota, formula zakona radioaktivnog raspada pomaže u određivanju vremena od kraja tjelesnog života.

Studije radioaktivnosti provedene su ulaboratorijski uvjeti. Nevjerojatna sposobnost radioaktivnih elemenata da ostanu aktivni satima, danima i čak godinama nije mogla ne iznenaditi fizičare s početka 20. stoljeća. Na primjer, studije torija popraćene su neočekivanim rezultatom: njegova aktivnost u zatvorenoj ampuli bila je značajna. Na najmanji dah pala je. Pokazalo se da je zaključak jednostavan: transformacija torija popraćena je oslobađanjem radona (plina). Svi se elementi u procesu radioaktivnosti pretvaraju u potpuno drugačiju tvar koja se razlikuje i po fizikalnim i po kemijskim svojstvima. Ova je supstanca, pak, također nestabilna. Trenutno su poznate tri serije sličnih transformacija.
Znanje o takvim transformacijama izuzetno je važno uodređivanje vremena nepristupačnosti zona zagađenih u procesu atomskih i nuklearnih istraživanja ili katastrofa. Poluvrijeme plutonija - ovisno o njegovom izotopu - kreće se od 86 godina (Pu 238) do 80 milijuna godina (Pu 244). Koncentracija svakog izotopa daje ideju o razdoblju dezinfekcije područja.
Poznato je da u naše vrijeme postoje metaliznatno skuplje od zlata, srebra i platine. To uključuje plutonij. Zanimljivo je da plutonij stvoren u procesu evolucije nije pronađen u prirodi. Većina elemenata dobiva se u laboratorijskim uvjetima. Eksploatacija plutonija-239 u nuklearnim reaktorima omogućila mu je da danas postane izuzetno popularan. Dobivanje dovoljne količine ovog izotopa za upotrebu u reaktorima čini ga praktično neprocjenjivim.

Plutonij-239 proizvodi se prirodnokao posljedica lanca transformacija urana-239 u neptunij-239 (vrijeme poluraspada - 56 sati). Sličan lanac omogućuje akumuliranje plutonija u nuklearnim reaktorima. Stopa pojavljivanja potrebne količine premašuje prirodnu stopu u milijardama puta.
Možete puno razgovarati o nedostacima nuklearne energijeenergije i o "čudnosti" čovječanstva koje koristi gotovo svako otkriće kako bi uništilo vlastitu vrstu. Otkriće plutonija-239, koji može sudjelovati u nuklearnoj lančanoj reakciji, omogućilo ga je korištenje kao izvora mirne energije. Uran-235, koji je analog plutonija, izuzetno je rijedak na Zemlji, mnogo je teže odvojiti ga od uranove rude nego dobiti plutonij.
Radioizotopska analiza izotopa radioaktivnih elemenata daje precizniju predodžbu o životnom vijeku određenog uzorka.
Koristeći lanac pretvorbe uran-torij,sadržanu u zemljinoj kori, omogućuje određivanje starosti našeg planeta. U osnovi ove metode leži postotni udio ovih elemenata u cijeloj zemljinoj kori. Prema najnovijim podacima, starost Zemlje je 4,6 milijardi godina.


























