
Termodinamika kao neovisni presjekfizička znanost nastala je u prvoj polovici 19. stoljeća. Doba strojeva je puklo. Industrijska revolucija potrebna je za proučavanje i razumijevanje procesa povezanih s radom toplinskih strojeva. U zoru strojne ere, usamljeni izumitelji mogli su si priuštiti samo korištenje intuicije i "metode bockanja". Nije bilo javnog reda za otkrića i izume, nitko nije mogao ni zamisliti da bi mogli biti korisni. No kad su toplinski (a nešto kasnije i električni) strojevi postali osnova proizvodnje, situacija se promijenila. Znanstvenici su napokon postupno riješili terminološku zabunu koja je vladala do sredine 19. stoljeća, odlučivši kako nazvati energiju, koju silu, koji impuls.
Počnimo s općim znanjem.Klasična termodinamika temelji se na nekoliko postulata (načela) koji su se dosljedno uvodili tijekom 19. stoljeća. Odnosno, ove odredbe nisu dokazive u njegovim okvirima. Formulirane su kao rezultat generalizacije empirijskih podataka.
Prvi početak je primjena zakona očuvanjaenergije za opis ponašanja makroskopskih sustava (koji se sastoje od velikog broja čestica). Ukratko, to se može formulirati na sljedeći način: opskrba unutarnjom energijom izoliranog termodinamičkog sustava uvijek ostaje konstantna.
Smisao drugog zakona termodinamike je odrediti smjer u kojem se procesi odvijaju u takvim sustavima.
Treći princip omogućuje vam točno određivanje takve količine kao što je entropija. Razmotrimo to detaljnije.
Formulacija drugog zakona termodinamike bila jekoju je 1850. predložio Rudolf Clausius: "Spontani prijelaz topline iz manje zagrijanog tijela u zagrijanije nemoguće je." U isto vrijeme, Clausius je naglasio zaslugu Sadija Carnota, koji je još 1824. godine ustanovio da udio energije koji se može pretvoriti u rad toplinskog stroja ovisi samo o temperaturnoj razlici između grijača i hladnjaka.

S daljnjim razvojem drugog početkatermodinamika Clausius uvodi koncept entropije - mjeru količine energije koja se nepovratno pretvara u oblik koji je neprikladan za uporabu. Clausius je tu vrijednost izrazio formulom dS = dQ / T, gdje je dS, koja određuje promjenu entropije. Ovdje:
dQ je promjena topline;
T je apsolutna temperatura (ona koja se mjeri u kelvinu).
Jednostavan primjer:dodirnite haubu svog automobila dok motor radi. Jasno je da je toplije od okoliša. No motor automobila nije dizajniran za zagrijavanje haube ili vode u hladnjaku. Pretvarajući kemijsku energiju benzina u toplinsku, a zatim u mehaničku energiju, obavlja koristan posao - rotira vratilo. No većina generirane topline se gubi jer se iz nje ne može izvući nikakav koristan rad, a ono što izlazi iz ispušne cijevi nipošto nije benzin. U tom slučaju toplinska energija se gubi, ali ne nestaje, već se rasipa (rasipa). Vrući poklopac motora, naravno, hladi se, a svaki ciklus cilindra u motoru ponovno dodaje toplinu. Dakle, sustav nastoji postići termodinamičku ravnotežu.
Klausije je za drugi početak izveo opće načelotermodinamika u formuli dS ≥ 0. Njegovo se fizičko značenje može definirati kao "ne-opadajuća" entropija: u reverzibilnim procesima se ne mijenja, u nepovratnim se povećava.
Valja napomenuti da su svi stvarni procesinepovratan. Izraz "ne smanjuje se" odražava samo činjenicu da je teoretski moguća idealizirana varijanta također uključena u razmatranje fenomena. Odnosno, količina nedostupne energije u bilo kojem spontanom procesu se povećava.
Max Planck dao je značajan doprinos razvojutermodinamika. Osim što je radio na statističkoj interpretaciji drugog zakona, aktivno je sudjelovao u postuliranju trećeg zakona termodinamike. Prva formulacija pripada Walteru Nernstu i datira iz 1906. godine. Nernstov teorem razmatra ponašanje ravnotežnog sustava pri temperaturama koje teže apsolutnoj nuli. Prvi i drugi princip termodinamike ne omogućuju otkrivanje kolika će entropija biti pod zadanim uvjetima.

Pri T = 0 K, energija je nula, čestice sustavazaustaviti kaotična toplinska kretanja i oblikovati uređenu strukturu, kristal s termodinamičkom vjerojatnošću jednakom jedinici. To znači da entropija također nestaje (u nastavku ćemo saznati zašto se to događa). U stvarnosti, to čak čini i nešto ranije, iz čega proizlazi da je hlađenje bilo kojeg termodinamičkog sustava, bilo kojeg tijela do apsolutne nule nemoguće. Temperatura će se ovoj točki proizvoljno približiti, ali je neće dostići.
Clausius je generalizirao i formulirao prvi i drugi princip termodinamike na sljedeći način: ukupna energija svakog zatvorenog sustava uvijek ostaje konstantna, a ukupna entropija raste s vremenom.
Prvi dio ove izjave nameće zabranuStroj za vječno gibanje prve vrste je uređaj koji obavlja posao bez priljeva energije iz vanjskog izvora. Drugi dio također zabranjuje vječni stroj druge vrste. Takav stroj preveo bi energiju sustava u rad bez naknade za entropiju, bez kršenja zakona očuvanja. Bilo bi moguće ispumpati toplinu iz ravnotežnog sustava, na primjer, pržiti jaja ili uliti čelik koristeći energiju toplinskog kretanja molekula vode, dok je hladi.
Drugi i treći princip termodinamike zabranjuju vječni stroj druge vrste.
Jao, od prirode ne možete dobiti ništa, ne samo besplatno, već morate platiti i proviziju.

Postoji nekoliko koncepata u znanosti koji su uzrokovalionoliko dvosmislenih emocija ne samo u široj javnosti, već i među samim znanstvenicima, koliko se računalo i s entropijom. Fizičari, a prije svega sam Clausius, gotovo su odmah ekstrapolirali zakon o smanjenju, najprije na Zemlju, a zatim i na cijeli Svemir (zašto ne, jer se može smatrati i termodinamičkim sustavom). Kao rezultat toga, fizička veličina, važan element izračuna u mnogim tehničkim primjenama, počela se doživljavati kao utjelovljenje neke vrste univerzalnog zla koje uništava svijetli i ljubazni svijet.
Među znanstvenicima postoje i takva mišljenja:budući da, prema drugom zakonu termodinamike, entropija nepovratno raste, prije ili kasnije sva će se energija Svemira razgraditi u raspršeni oblik i doći će do „toplinske smrti“. Zbog čega treba biti sretan? Clausius je, na primjer, nekoliko godina oklijevao objaviti svoja otkrića. Naravno, hipoteza o "toplinskoj smrti" odmah je pobudila mnoge zamjerke. Postoje ozbiljne sumnje u njegovu ispravnost i sada.
1867. James Maxwell, jedan od autoramolekularno-kinetička teorija plinova u vrlo vizualnom (iako izmišljenom) pokusu pokazala je prividnu paradoksalnost drugog zakona termodinamike. Iskustvo se može ukratko sažeti na sljedeći način.
Neka postoji posuda s plinom.Molekule se u njemu kreću kaotično, njihove brzine su nešto drugačije, ali je prosječna kinetička energija ista u cijelom plovilu. Sada posudu s pregradom dijelimo na dva izolirana dijela. Prosječna brzina molekula u obje polovice posude ostat će ista. Pregradu čuva maleni demon koji omogućuje bržim, "vrućim" molekulama da prodru u jedan dio, a sporije "hladne" u drugi. Kao rezultat toga, u prvoj polovici plin će se zagrijati, u drugoj će se ohladiti, odnosno iz stanja termodinamičke ravnoteže sustav će se pomaknuti na razliku u temperaturnim potencijalima, što znači smanjenje entropije.
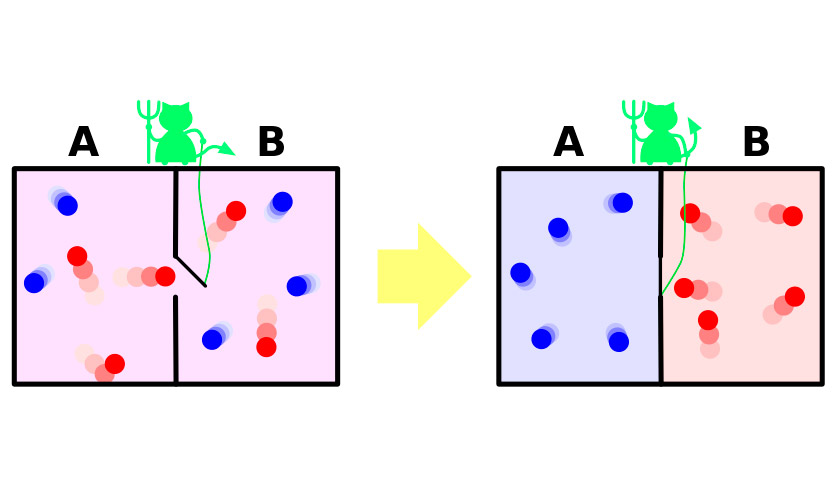
Cijeli problem je u tome što je u eksperimentu sustavne čini ovaj prijelaz spontano. Prima energiju izvana, zbog čega se pregrada otvara i zatvara, ili sustav nužno uključuje demona koji troši svoju energiju na ispunjavanje dužnosti čuvara vrata. Povećanje entropije demona u višku pokriti će smanjenje nje u plinu.
Uzmite čašu vode i ostavite je na stolu.Staklo nije potrebno promatrati, dovoljno se nakon nekog vremena vratiti i provjeriti stanje vode u njemu. Vidjet ćemo da se njegov broj smanjio. Ako ostavite staklo na duže vrijeme, u njemu se uopće neće pronaći voda, jer će sve ispariti. Na samom početku procesa, sve molekule vode bile su u određenom području prostora ograničenom staklenim stijenkama. Na kraju pokusa raspršili su se po prostoriji. U volumenu prostorije molekule imaju mnogo više mogućnosti promijeniti mjesto bez ikakvih posljedica po stanje sustava. Nikada ih nećemo moći okupiti u zavareni "kolektiv" i otjerati natrag u čašu da piju vodu sa zdravstvenim prednostima.

To znači da je sustav evoluirao dostanje s većom entropijom. Na temelju drugog zakona termodinamike, entropija ili proces raspršivanja čestica sustava (u ovom slučaju molekula vode) je nepovratan. Zašto je tomu tako?
Clausius nije odgovorio na ovo pitanje, a nitko drugi to nije mogao učiniti prije Ludwiga Boltzmanna.
Taj je znanstvenik 1872. uveo u znanoststatističko tumačenje drugog zakona termodinamike. Uostalom, makroskopske sustave s kojima se termodinamika bavi tvore veliki broj elemenata čije se ponašanje pridržava statističkih zakona.
Vratimo se molekulama vode.Leteći kaotično po prostoriji, mogu zauzeti različite položaje, imati neke razlike u brzinama (molekule se stalno sudaraju jedna s drugom i s drugim česticama u zraku). Svaka varijanta stanja sustava molekula naziva se mikrostanjem, a takvih je varijanti ogroman broj. Kada se implementira velika većina opcija, stanje makroa sustava neće se promijeniti na bilo koji način.
Poznata relacija S = k lnW povezuje brojmoguće načine na koje se može izraziti određeno makro stanje termodinamičkog sustava (W), s njegovom entropijom S. Vrijednost W naziva se termodinamička vjerojatnost. Konačan oblik ovoj formuli dao je Max Planck. Koeficijent k je izuzetno mali (1,38 × 10−23 J / K), koji karakterizira odnos energije i temperature, Planck je nazvao Boltzmannovu konstantu u čast znanstvenika koji je prvi predložio statističku interpretaciju drugog zakona termodinamike.

Jasno je da je W uvijek prirodni broj 1, 2, 3,… N(ne postoji razlomačan broj načina). Tada logaritam W, a time i entropija, ne mogu biti negativni. Na jedinom mogućem mikrostanju sustava, entropija postaje nula. Ako se vratimo čaši, ovaj se postulat može predstaviti na sljedeći način: molekule vode, nasumično jureći po prostoriji, vraćaju se natrag u čašu. U isto vrijeme, svaki je točno ponovio svoj put i zauzeo isto mjesto u staklu kao i prije leta. Ništa ne zabranjuje provedbu ove opcije u kojoj je entropija nula. Samo čekati provedbu tako nestajuće male vjerojatnosti ne isplati se. Ovo je jedan primjer nečega što se može postići samo teoretski.
Dakle molekule kaotično lete po prostoriji.različiti putevi. Nema pravilnosti u njihovom rasporedu, nema reda u sustavu, bez obzira na to kako promijenili varijante mikrostanja, ne može se pratiti nikakva razumljiva struktura. U staklu je bilo isto, ali zbog ograničenog prostora molekule nisu tako aktivno mijenjale svoj položaj.
Kaotično, poremećeno stanje sustavakao što najvjerojatnije odgovara njegovoj maksimalnoj entropiji. Voda u čaši primjer je stanja niže entropije. Prijelaz na njega iz kaosa ravnomjerno raspoređenog po prostoriji praktički je nemoguć.
Navedimo primjer koji je svima nama razumljiviji -čišćenje nereda u kući. Da bismo sve stavili na svoje mjesto, moramo potrošiti i energiju. U procesu ovog rada postajemo vrući (odnosno, ne smrzavamo se). Pokazalo se da entropija može biti korisna. Zaista je tako. Može se reći još više: entropija, a preko nje drugi zakon termodinamike (zajedno s energijom) upravlja Svemirom. Pogledajmo još jednom reverzibilne procese. Ovako bi svijet izgledao da nema entropije: bez razvoja, bez galaksija, zvijezda, planeta. Nema života ...

Još nekoliko informacija o "toplinskoj smrti".Ima dobrih vijesti. Budući da su, prema statističkoj teoriji, "zabranjeni" procesi zapravo malo vjerojatni, fluktuacije nastaju u termodinamički ravnotežnom sustavu - spontana kršenja drugog zakona termodinamike. Mogu biti veliki koliko želite. Kad se gravitacija uključi u termodinamički sustav, raspodjela čestica više neće biti kaotično ujednačena, a neće se postići ni stanje najveće entropije. Štoviše, Svemir nije nepromjenjiv, stalan i stacionaran. Posljedično, sama formulacija pitanja "toplinske smrti" je besmislena.


























